A quantidade de calorias depende da constituição do alimento. Assim, para determinarmos experimentalmente a quantidade de calor liberado pelo alimento e que poderá ser absorvida pelo organismo, usamos um aparelho denominado calorímetro.
Esse aparelho mede o calor liberado pelo alimento ao ser queimado. Existem vários tipos de calorímetro; o primeiro deles foi criado em 1780 por Lavoisier e Laplace e era um calorímetro de gelo.
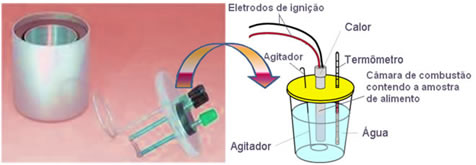
Hoje em dia, o mais utilizado e que leva em conta o conceito de caloria explanado acima é o calorímetro de água. Esse aparelho é revestido por um material isolante, para evitar que ocorram perdas de calor com o meio; e o alimento que será analisado é colocado na câmara de combustão, que contém gás oxigênio e eletrodos. Esses eletrodos sofrem uma descarga elétrica e provocam sua ignição e a combustão do alimento.
A massa conhecida de água contida no calorímetro absorve o calor liberado pelo alimento queimado e um termômetro mede o aumento da temperatura da água. Além disso, o calorímetro contém um agitador que permite que a temperatura da água permaneça uniforme em toda a sua extensão.
Assim, se utilizarmos, por exemplo, uma massa de 1 grama de açúcar e no calorímetro tiver 1000 g de água, e observarmos que ao final da reação a temperatura da água passou de 20°C para 24°C, ou seja, aumentou 4°C, poderemos então chegar no valor energético do açúcar. Como? Bem, considerando o conceito inicial de caloria, temos:
| Elevar de 1°C → 1 cal por grama de água |
| Elevar de 4°C → 4 cal por grama de água |
Assim, 1 g de água absorve 4 cal. Porém, foram utilizadas 1000 g de água e, considerando que todo calor liberado na combustão foi absorvido por ela, a energia total absorvida pela água foi de 4000 cal ou 4 kcal. Por isso, concluímos que:
| O valor energético do açúcar = 4000 cal/g ou 4 kcal/g. |
Transformando para o SI:
1 kcal ------------ 4,18 kJ
4 kcal/g ------------ x
x = 16, 72 kJ/g
Além disso, podemos usar a seguinte equação para calcular a quantidade de calor cedido ou absorvido pela água:
| Q = m . c. Δt |
Onde:
Q = calor cedido ou absorvido pela água;
m = massa da água;
c = calor específico da água, que é igual a 1,0 cal/g . °C ou 4,18 J/g . °C;
Δt = variação da temperatura sofrida pela água, que é dada pela diminuição da temperatura final pela inicial (tf – ti).
Usando essa fórmula chegamos ao mesmo resultado:
Q = m . c. Δt
Q = 1000 g . 1,0 cal / g . °C. (24-20)°C
Q= 4000 cal
Q = 4,0 kcal
ou
Q = m . c. Δt
Q = 1000 g . 4,18 kJ / g . °C. (24-20)°C
Q= 16,72 kJ
Por Jennifer Fogaça
Graduada em Química