No cotidiano e em laboratórios, existem reações e transformações que são espontâneas e outras que não são espontâneas. Por exemplo, toda combustão é uma reação espontânea, porque uma vez iniciada, ela irá continuar até que todo o combustível seja consumido ou até que todo o oxigênio acabe.
Por outro lado, a eletrólise é um processo não espontâneo, em que a energia elétrica é transformada em energia química. Um exemplo é a eletrólise do cloreto de sódio (NaCl). Quando se passa uma corrente elétrica sobre esse sal fundido, há reações de oxirredução e a formação de sódio metálico (Na(s)) e gás cloro (Cl2(g)). Se pararmos de passar a corrente elétrica, a reação não continuará sozinha, o que mostra que ela não é espontânea.
A espontaneidade de uma reação pode ser medida por meio da equação de Gibbs-Helmholtz, dada abaixo:

Em que:
∆G = variação da energia livre;
∆H = variação da entalpia;
T = temperatura em Kelvin (sempre positiva);
∆S = variação da entropia.
Essa equação leva esse nome porque ela foi proposta pelo físico norte-americano J. Willard Gibbs (1839-1903) e pelo físico alemão Hermann Helmholtz (1821-1894).
Para entendermos melhor como essa equação nos ajuda a determinar a espontaneidade de uma reação, relembremos brevemente cada um dos conceitos envolvidos nela:
- ∆H (variação da entalpia): Entalpia (H) é o conteúdo de energia de uma substância. Até o momento, não é conhecida nenhuma maneira de determiná-la. Na prática, o que se consegue é medir a variação da entalpia (∆H) de um processo, utilizando-se calorímetros. Essa variação é a quantidade de energia que foi liberada ou absorvida no processo.
- ∆S (variação da entropia): A entropia (S) é a grandeza termodinâmica que mede o grau de desordem de um sistema.
Por exemplo, na fusão do gelo, as moléculas passam do estado sólido para o líquido, onde há uma maior desorganização. Isso significa que nesse processo a entropia aumentou (∆S > 0).
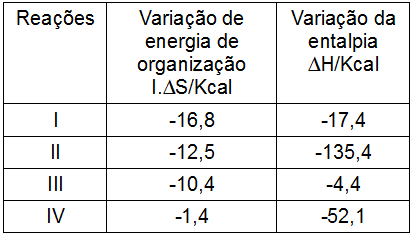
Na produção da amônia (NH3), 1 mol de gás nitrogênio reage com 3 mol de gás hidrogênio (ou seja, 4 mol de moléculas nos reagentes), originando 2 mol de amônia:
N2(g) +3 H2(g) → 2 NH3(g)
Visto que o número de moléculas na fase gasosa diminui nesse processo, a desorganização diminuiu, o que significa que a entropia também diminuiu (∆S< 0).
- ∆G (Energia livre): A energia livre ou energia livre de Gibbs (porque foi proposta apenas por esse cientista em 1878) é a energia útil do sistema que é usada para realizar trabalho.
Um sistema possui uma energia global, mas apenas uma fração dessa energia será usada para realizar trabalho, essa é a chamada energia livre de Gibbs, simbolizada por G.
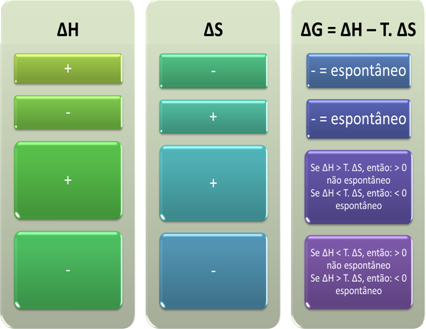
Segundo Gibbs, um processo é considerado espontâneo se realizar trabalho, ou seja, se G diminuir. Nesse caso, o estado final da transformação será mais estável que o inicial quando ∆G < 0.
Baseado nisso, podemos concluir o seguinte:

Podemos também ver se um processo será espontâneo olhando o sinal algébrico de ∆H e de ∆S na equação de Gibbs-Helmholtz:
Por Jennifer Fogaça
Graduada em Química