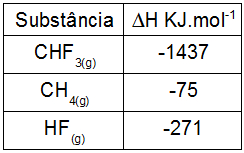
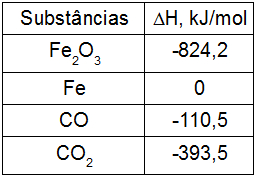
Realizar o cálculo da entalpia de uma reação significa determinar a variação de energia que houve desde a mistura dos reagentes até a formação dos produtos. Na equação a seguir, temos a representação de reagentes e produtos
A + B → C + D
-
A + B = Reagentes
-
C + D = Produtos
Cada participante de uma reação apresenta uma entalpia (H), ou seja, cada participante apresenta certa quantidade de energia. Durante a ocorrência da reação, as ligações entre os reagentes são quebradas e as ligações entre os átomos dos produtos são formadas. Dessa forma, durante a reação química, estabelece-se uma variação de energia.
Para determinar o cálculo da entalpia de uma reação, é necessário primeiramente conhecer as entalpias individuais de cada um dos participantes. Normalmente os exercícios sempre fornecem os valores das entalpias de reagentes e produtos. Por exemplo:
ZnS + O2 → ZnO + SO2
-
HZnS = - 49,23 Kcal/mol
-
HO2 = 0 Kcal/mol
-
HZnO = - 83,24 Kcal/mol
-
HSO2 = - 70,994 Kcal/mol
Se tivéssemos uma substância simples, o valor da entalpia seria igual a zero. No entanto, vale ressaltar que, se na reação a substância simples for um alótropo, devemos ter o cuidado de saber se lidamos com o alótropo mais estável do elemento químico que forma essa substância. O alótropo mais estável sempre apresenta entalpia igual a zero, por isso o exercício não realizará essa indicação. Veja uma tabela com os elementos que formam alótropos e aqueles que são mais estáveis:
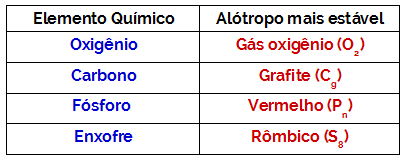
OBS.: A forma alotrópica mais estável do elemento indica a substância encontrada em maior quantidade na natureza.
O cálculo da entalpia da reação é chamado, de forma geral, de variação da entalpia e sempre é representado pela sigla ∆H. Como se trata de uma variação, o cálculo da entalpia da reação envolve a subtração entre a entalpia dos produtos pela entalpia dos reagentes:
∆H = HP - HR
A realização do cálculo da variação da entalpia permite identificarmos se a reação é endotérmica ou exotérmica. Se o resultado for negativo, a reação será exotérmica; já se o resultado for positivo, a reação será endotérmica.
∆H = - (Exotérmico)
∆H = + (Endotérmico)
Ao realizar o cálculo da variação da entalpia de uma reação, é muito importante que estejamos muito atentos ao balanceamento, já que os valores das entalpias fornecidos pelo exercício sempre são expressados em mol. Assim, se o participante da reação apresentar mais de um mol, devemos multiplicar o valor da sua entalpia pela sua quantidade expressa no balanceamento. Veja um exemplo:
2 ZnS + 3 O2 → 2 ZnO + 2 SO2
Observamos que os coeficientes que fazem o balanceamento da equação são 2, 3, 2 e 2. Assim, os valores das entalpias de cada um dos participantes serão:
-
HZnS = - 49,23 . 2 = - 98,46 Kcal/mol
-
HO2 = 0 . 3 = 0 Kcal/mol
-
HZnO = - 83,24 . 2 = - 166,48 Kcal/mol
-
HSO2 = - 70,994 . 2 = - 141,988 Kcal/mol
A partir desses dados, podemos realizar o cálculo da variação da entalpia da reação. Vale relembrar que os valores dos produtos devem ser somados entre si, assim como os dos reagentes:
∆H = HP - HR
∆H = [(-166,48) + (-141,998)] - [(-98,46) + 0]
∆H = (- 308,468) – (-98,46)
∆H = -308,468 + 98,46
∆H = - 210,008 Kcal/mol
OBS.: Como o resultado foi negativo, essa reação é exotérmica.
Agora acompanhe a resolução de um exercício de vestibular sobre o cálculo da entalpia de uma reação:
(UFMS) O valor do H para a equação balanceada abaixo é de: Dados: HAg2S = - 32,6 KJ/mol, HH2O = - 285,8 KJ/mol, HH2S = - 20,6 KJ/mol,
2 Ag2S + 2 H2O → 4 Ag + 2 H2S + O2
a) 485,6 KJ
b) 495,6 KJ
c) 585,6 KJ
d) 595,6 KJ
e) 600 KJ
Os dados fornecidos pelo exercícios são:
OBS.: Como temos o O2 na equação, que é o alótropo mais estável do oxigênio, sua entalpia vale 0 KJ. Como o Ag é uma substância simples, sua entalpia vale 0 KJ.
HAg2S = - 32,6 KJ/mol
HH2O = - 285,8 KJ/mol
HH2S = - 20,6 KJ/mol
Levando em consideração o balanceamento, devemos multiplicar o coeficiente pela entalpia de cada um dos participantes:
HAg2S = - 32,6 . 2 = - 65,2 KJ
HH2O = - 285,8 . 2 = - 571,6 KJ
HH2S = - 20,6. 2 = - 41,2 KJ
HO2 = 0. 1 = 0 KJ
HAg = 0. 4 = 0 KJ
Por fim, basta utilizar os dados na fórmula da variação da entalpia:
∆H = HP - HR
∆H = [(0) + (-41,2) + 0] - [(-65,2) + (-571,6)]
∆H = (- 41,2) – (-636,8)
∆H = -41,2 + 636,8
∆H = 595,6 Kcal/mol
Como o resultado da variação foi positivo, a reação é endotérmica.
Por Me. Diogo Lopes Dias