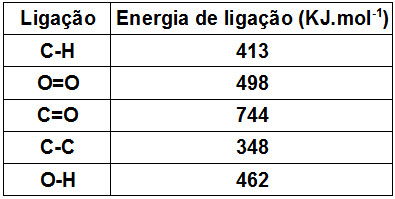
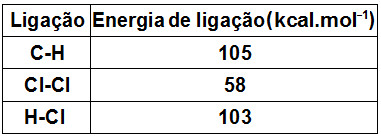
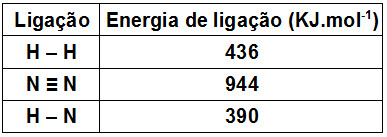
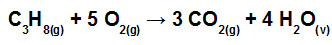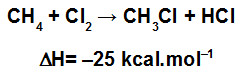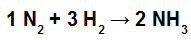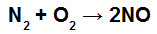Quando ocorrem reações químicas, ocorre também quebra das ligações existentes nos reagentes, mas novas ligações são formadas nos produtos. Esse processo envolve o estudo da variação de energia que permite determinar a variação de entalpia das reações.
O fornecimento de energia permite a quebra de ligação dos reagentes, esse processo é endotérmico, mas à medida que as ligações entre os produtos se formam o processo muda: fica exotérmico. Por quê? Ocorre a liberação de energia.
A energia liberada na formação de uma ligação é numericamente igual à energia absorvida na quebra desta ligação, portanto a energia de ligação é definida para a quebra de ligações.
Resumindo: Energia de ligação é a energia absorvida na quebra de 1 mol de ligações, no estado gasoso, a 25 °C e 1 atm.
Por Líria Alves
Graduada em Química