A entalpia (H) pode ser definida como o conteúdo de energia de cada material ou como a energia global de um sistema. Porém, não é possível, na prática, determinar a entalpia de uma substância. Assim, o que se costuma medir é a variação da entalpia 

Iremos analisar aqui a variação da entalpia em reações exotérmicas (a palavra “exo” vem do grego e significa “fora, fora de, para fora”), que são aquelas reações em que há liberação de calor. No dia a dia existem muitos exemplos de ocorrência dessas reações, como as combustões e a mistura de cal virgem com água.
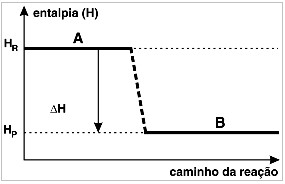
Nesses casos, a variação de entalpia 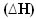 será exatamente a quantidade de calor liberado, dada pelo valor da entalpia final menos a entalpia inicial (Hf – Hi) ou, como se trata de uma reação, o valor da entalpia dos produtos menos o dos reagentes (HP – HR).
será exatamente a quantidade de calor liberado, dada pelo valor da entalpia final menos a entalpia inicial (Hf – Hi) ou, como se trata de uma reação, o valor da entalpia dos produtos menos o dos reagentes (HP – HR).
Como se libera calor, perde-se energia. Assim, a energia total do sistema diminui, de forma que a entalpia dos produtos será sempre menor que a dos reagentes, por isso a variação da entalpia em reações exotérmicas será sempre negativa, menor que zero 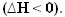
Considerando uma reação exotérmica genérica:
| A → B + calor |
Isso pode ser expresso por meio de um diagrama de entalpia, como o abaixo:
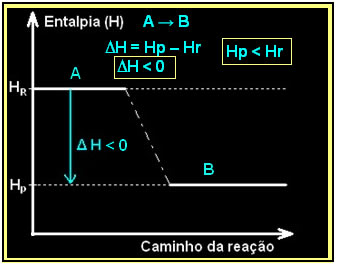
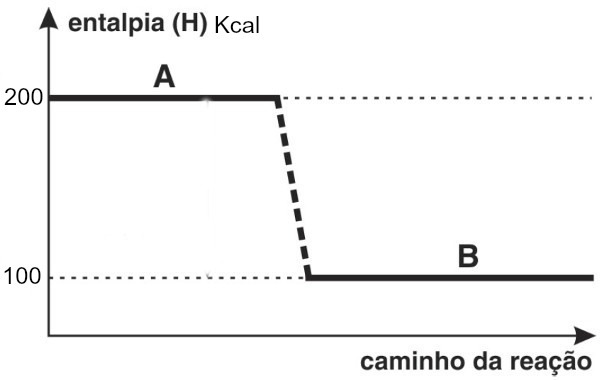
A combustão do gás hidrogênio, com formação de água líquida, ocorre com liberação de energia. O valor da variação da entalpia do sistema nessa reação é dado por:
2H2(g) + O2(g) → 2H2O(l) .jpg) = - 572 kJ
= - 572 kJ
Seu diagrama ficaria representado da seguinte forma:
.jpg)
Por Jennifer Fogaça
Graduada em Química