Uma reação de neutralização ocorre quando um ácido reage com uma base formando água e sal. O ácido fornece os íons H+ e a base fornece os íons OH- para a formação da água (H2O):
1 H+(aq) + 1 OH-(aq) → H2O(ℓ)
Esse tipo de reação é denominada de “neutralização” porque o pH do meio é neutralizado; o pH da água é 7,0 (neutro).
Para que essas reações ocorram é necessário que se libere certa quantidade de calor, pois apenas uma parte da energia dos íons é usada para formar as ligações que resultam nas moléculas de água, enquanto que o restante da energia é liberado para o meio. Essa energia liberada é denominada Entalpia de Neutralização (∆Hneutralização).

Visto que libera calor, corresponde a reações exotérmicas, em que a entalpia (energia global do sistema) sempre será negativa, menor que zero.
No caso da reação entre ácidos fortes e bases fortes o valor da entalpia de neutralização sempre será igual a – 13,8 kcal/mol ou – 57,7 kJ/mol. Isso acontece porque as bases e os ácidos fortes ficam dissociados completamente em solução e, com isso, a única reação responsável pela manifestação do calor será a da formação da água, como mostrado nos três exemplos abaixo:
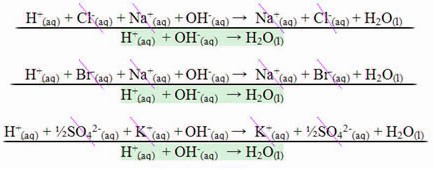
No caso de reações de neutralização que envolvam ácidos ou bases fracas, o valor da entalpia de neutralização será menor que – 57,7 kJ/mol.
Por Jennifer Fogaça
Graduada em Química