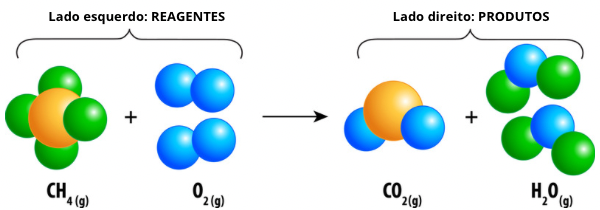
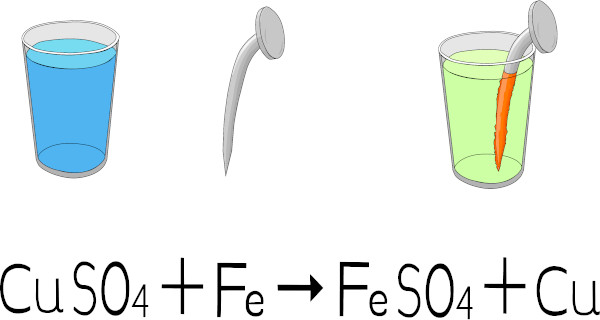As equações químicas são formas de representação simbólica de processos químicos, colocando-se os reagentes à esquerda e os produtos à direita. Nas equações químicas, utilizam-se símbolos específicos para não só identificar os participantes, mas também condições específicas, tais como calor, luz, catalisador etc.
Essas equações precisam seguir as leis da Química, bem como as leis ponderais. Por isso, deve-se fazer o balanceamento adequado, seja pelo método das tentativas, seja pelo método redox. Entre os principais tipos de equações químicas destacam-se as comuns, do nosso cotidiano, assim como as reações iônicas.
Leia também: Qual é a diferença entre fenômenos físicos e químicos?
Tópicos deste artigo
- 1 - Resumo sobre equações químicas
- 2 - Representação das equações químicas
- 3 - Símbolos das equações químicas
- 4 - Tipos de equações químicas
- 5 - Balanceamento de equações químicas
- 6 - Exercícios resolvidos sobre equações químicas
Resumo sobre equações químicas
- Uma equação química é uma representação simbólica de um processo químico.
- Os reagentes são colocados à esquerda, enquanto os produtos são colocados à direita.
- Utilizam-se símbolos específicos para indicar as condições físico-químicas da reação.
- Toda equação química obedece, assim como os processos químicos, as leis ponderais. Por isso, faz-se necessário balancear as reações antes de iniciar a análise adequada.
Representação das equações químicas
As equações químicas são representações simbólicas de um processo químico, estruturadas de modo que os reagentes fiquem à esquerda e os produtos, à direita, conforme a imagem a seguir:
Antes de cada símbolo de um elemento participante, números são colocados para indicar o coeficiente (ou número) estequiométrico.
Símbolos das equações químicas
Os participantes de uma reação química são indicados pelos símbolos de seus elementos químicos, os quais podem ser encontrados na Tabela Periódica.
O estado físico de agregação, ou a forma de apresentação da substância, também pode ser indicado, da seguinte forma:
- (g) para substâncias gasosas;
- (l) para substâncias líquidas;
- (s) para substâncias sólidas;
- (aq) para substâncias dissolvidas em solução aquosa.
As setas também dizem muito acerca da equação química:
- → : indica que a reação só se propaga no sentido direto.
- ⇌ : indica que a reação é reversível, usada em equilíbrios químicos.
Sobre as setas das reações, é possível colocar símbolos específicos para indicar as condições reacionais ou outras informações necessárias:
- cat.: para indicar um catalisador.
- hν ou λ: para indicar a presença de luz.
- Δ: para indicar utilização de calor.
- H+: para indicar que a reação ocorre em meio ácido.
- OH-: para indicar que a reação ocorre em meio básico.
- : para indicar a utilização de um oxidante.
- ↓: ao lado de um participante da reação indica que ele precipitou.
- ↗ ou ↑: ao lado de um participante da reação indica que ele se desprendeu como gás.
Também é comum colocar sobre a seta a fórmula de uma substância específica. Tal método é empregado quando queremos especificar as condições. Por exemplo, nas reações de acilação de Friedel-Crafts demonstradas a seguir:
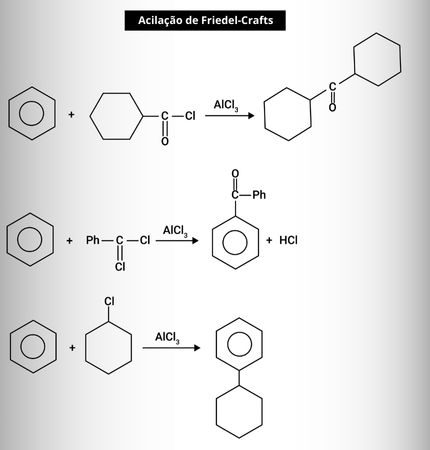
Repare a indicação do catalisador “AlCl3” sobre a seta, de modo a não deixar dúvidas sobre qual catalisador foi empregado.
Leia também: Termos quantitativos em uma equação química
Tipos de equações químicas
Uma equação química pode representar dois tipos de reação química: uma comum e uma iônica.
- Reação química comum ou tradicional: os participantes estão na forma neutra, sem a indicação de cargas.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
- Reação química na forma iônica: alguns dos participantes são íons e, por isso, têm suas cargas representadas.
Ag+ (aq) + Cl- (aq) ⇌ AgCl (s)
Balanceamento de equações químicas
Os processos químicos ocorrem com conservações de massa e carga, por isso deve-se fazer o balanceamento da equação química, que consiste em uma forma de respeitar as conservações.
- Balanceamento pelo método das tentativas (conservação de massa): nesse método, colocam-se os coeficientes estequiométricos de forma direta, tentando igualar as quantidades de reagentes e produtos. Utilizam-se regras empíricas para auxiliar, como é o caso da regra do MACHO.
Ex.: HCl + Al(OH)3 → AlCl3 + H2O
Para balancear, a quantidade dos elementos deve ser igual antes e após a seta. A regra do MACHO nos auxilia nesse caso, apresentando uma ordem a ser acertada: Metal, Ametal, Carbono, Hidrogênio, Oxigênio.
Assim, começa-se pelo alumínio (metal). Porém, o número de átomos de alumínio antes e após a seta são iguais (apenas 1), por isso não se altera nada até então.
Passando para o ametal, temos o cloro. Há apenas um átomo de cloro nos reagentes, enquanto há três nos produtos. Por isso, é feita a primeira correção:
3 HCl + Al(OH)3 → AlCl3 + H2O
Como não há átomos de carbono, seguimos para o hidrogênio. Ao lado esquerdo da seta, há 6 átomos de hidrogênio (3 no HCl e mais 3 no hidróxido de alumínio). Para igualar, multiplica-se a molécula de H2O por 3, pois 3 x 2 = 6.
3 HCl + Al(OH)3 → AlCl3 + 3 H2O
Por fim, sobra o oxigênio. Contudo, percebe-se que em ambos os lados da equação química há 3 átomos de oxigênio. Assim, nota-se que a reação está balanceada.
- Balanceamento pelo método redox (conservação de carga): nesse método, avalia-se o número de elétrons recebidos ou perdidos pelas espécies envolvidas em uma oxirredução. Exemplo:
Zn + AgCl → ZnCl2 + Ag
Primeiramente, deve-se calcular o número de oxidação de todas as espécies participantes:
- Zn (reagente): carga zero.
- AgCl (reagente): Ag é +1 e Cl é -1.
- ZnCl2 (produto): Zn é +2 e Cl é -1.
- Ag (produto): carga zero.
Com isso, temos que o zinco sofreu oxidação (passou de carga 0 para +2) e perdeu dois elétrons. Já a prata sofreu redução (passou de +1 para carga 0) e recebeu um elétron. Como o número de elétrons perdidos deve ser igual ao número de elétrons recebidos, todas as substâncias que possuem o elemento prata devem ser multiplicadas por 2 (assim igualando com o número de elétrons perdidos pelo zinco).
Zn + 2 AgCl → ZnCl2 + 2 Ag
Depois, deve-se avaliar se alguma substância ainda não foi balanceada (afinal nem todas sofrem oxirredução). Nesse caso, tendo substâncias a serem balanceadas, deve-se utilizar o método das tentativas. Porém, na reação apresentada não foi necessário, pois todos os elementos ficaram devidamente balanceados.
-
Videoaula sobre balanceamento de equações químicas
Exercícios resolvidos sobre equações químicas
Questão 1
(Acafe-SC 2015) Íons Fe2+ podem ser quantificados em uma reação de oxirredução com íons MnO4– padronizados em meio ácido. Uma vez balanceada a equação química a seguir, a soma dos menores coeficientes estequiométricos inteiros dos reagentes é:
MnO4– (aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + H2O + Fe3+(aq)
a) 10
b) 3
c) 14
d) 5
Resposta:
Letra C
Para saber a soma dos coeficientes, deve-se fazer o balanceamento, nesse caso, pelo método redox.
- O Mn reduz: +7 para +2, recebendo 5 elétrons.
- O Fe oxida: +2 para +3, perdendo 1 elétron.
Assim, todas as substâncias que tenham ferro devem ser multiplicadas por 5.
MnO4– (aq) + 5 Fe2+(aq) + H+(aq) → Mn2+(aq) + H2O + 5 Fe3+(aq)
Agora, procede-se o balanceamento pelo método das tentativas (MACHO). Chega-se a:
MnO4– (aq) + 5 Fe2+(aq) + 8 H+(aq) → Mn2+(aq) + 4 H2O + 5 Fe3+(aq)
O somatório dos coeficientes dos reagentes é: 1 + 5 + 8 = 14.
Questão 2
(UFPR 2005) Das equações abaixo, qual(quais) está(estão) balanceada(s) corretamente?
I. NH3 + HCl → NH4Cl
II. BaCl2 + H2SO4 → HCl + BaSO4
III. C2H6O + O2 → CO2 + H2O
IV. N2 + H2 → NH3
a) Somente I.
b) Somente II.
c) Somente I e III.
d) Somente II e IV.
e) Somente III e IV.
Resposta:
Letra A
Observa-se, entre as reações, que apenas a de número I possui quantidades iguais dos elementos quando comparados reagentes com produtos.
Por Stéfano Araújo Novais
Professor de Química