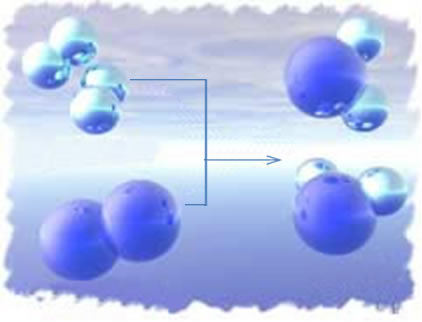
Conforme dito no texto “Equação Química”, para representar as reações químicas e se entender a forma com que elas se processam, seus aspectos quantitativos e qualitativos, convencionou-se usar as equações químicas. As equações químicas contêm símbolos e números que mostram quais as substâncias presentes e as proporções adequadas em que elas reagem.
Por meio da interpretação dessas equações é possível encontrar dados importantes que nos ajudam a realizar cálculos estequiométricos. Porém, o primeiro passo diz que a equação deve estar balanceada, isto é, deve ter o número total de átomos dos reagentes igual ao dos produtos. Você pode entender como realizar esse balanceamento por meio do texto “Balanceamento de equações”.
Antes, porém, entenda alguns conceitos importantes nesse caso, como o significado dos termos: índice, coeficiente estequiométrico e mol. Esses termos serão explanados a seguir e nos dão um melhor vislumbre da parte quantitativa da reação:
- Índice: é o número que indica a quantidade de átomos de cada elemento presente nas fórmulas químicas. Esse número vem à direita do elemento em questão e aparece subscrito, isto é, num tamanho de fonte menor.
Exemplo:
H2O (fórmula química da substância água)
O que significa:
- Os elementos que constituem essa substância são o H (hidrogênio) e o O (oxigênio).
- O índice de cada elemento indica quantos átomos de cada um estão presentes na fórmula da molécula de água:
H2O→ Índice do O: só há 1 átomo de oxigênio.
↓
Índice do H: indica que há 2 átomos de hidrogênio.
Observe que no caso do oxigênio não há nenhum número escrito, o que significa que só há 1 átomo daquele elemento, como já explicado.
Agora, existem alguns casos em que aparecem parênteses nas fórmulas. Como devemos interpretar isso? Veja o exemplo abaixo:
Ca3(PO4)2(fórmula química da substância fosfato de cálcio)
- O índice do Ca indica que há 3 átomos do elemento cálcio presentes na fórmula química;
- O P (fósforo) e o O (oxigênio) estão entre parênteses, por isso o índice que está de fora, que no caso é o 2, pertence a ambos. Assim, para saber quantos átomos de cada um existem na fórmula, é preciso multiplicar seus índices separadamente pelo índice de fora. Observe como isso é feito:

P → índice 1 O → índice 4
P = 1 . 2 O = 4 . 2
P = 2 O = 8
Portanto, existem 2 átomos de fósforo e 8 de oxigênio.
- Coeficiente estequiométrico: é o número que vem antes da fórmula para indicar a quantidade de cada substância e a proporção de moléculas que participam da reação. Assim, como no caso do índice, quando o coeficiente for igual a 1, não é preciso escrevê-lo, pois ele está subentendido.
Exemplo:
2H2 + 1O2 → 2 H2O (essa reação de formação da água é mostrada na figura introdutória)
↓ ↓ ↓
Coeficientes da reação
Nessa equação, por meio dos coeficientes, mostra-se que duas moléculas do gás hidrogênio reagem com uma de gás oxigênio, para formar como produto duas moléculas de água. Assim, a proporção estequiométrica dessa reação é de 2:1:2.
Para descobrir a quantidade total de átomos de cada elemento que está presente na reação é preciso multiplicar os coeficientes pelos índices de cada elemento:
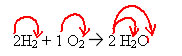
Reagentes:
H = 2 . 2 = 4 átomos de hidrogênio
O = 1 . 2 = 2 átomos de oxigênio
Produto:
H = 2 . 2 = 4 átomos de hidrogênio
O = 1 . 2 = 2 átomos de oxigênio
Observe que deu a mesma quantidade nos reagente e nos produtos, o que significa que a reação está balanceada corretamente.
- Mol (quantidade de matéria):em uma equação química, considera-se que os coeficientes indicam a quantidade de mol ou a quantidade de matéria. Assim, no caso anterior temos 2 mols de H2 reagindo com 1 mol de O2, gerando como produtos 2 mols de H2O.
Por Jennifer Fogaça
Graduada em Química