As leis ponderais são generalizações estabelecidas a partir do estudo das relações entre as massas das substâncias de uma reação química, que é sempre representada a partir de uma equação como a proposta a seguir:
A + B → C + D
Nessa equação, temos A e B antes da seta (indica o sentido da reação), que representam as substâncias responsáveis por promover a reação e, por isso, são chamadas de reagentes. Já as substâncias C e D são originadas a partir de A e B e, por isso, são denominadas de produtos.
Como reagentes e produtos são matérias e apresentam massa, as leis ponderais voltam-se exatamente para as relações entre as massas dessas substâncias. Veja quais são essas leis:
a) Lei da Conservação da Massa de Lavoisier (Lei de Lavoisier)
Foi proposta pelo pai da Química Moderna, o químico Antoine-Laurent Lavoisier. Após realizar diversos experimentos químicos em sistemas fechados, ou seja, que não permitem troca de matéria entre os meios, ele verificou que as substâncias combinadas (os reagentes) durante a reação e as substâncias formadas (os produtos) após a reação sempre apresentavam a mesma massa.
De acordo com Lavoisier, se uma reação química for realizada em um sistema fechado, a soma das massas dos reagentes será sempre igual à soma das massas dos produtos. Veja a generalização da lei de Lavoisier:
Soma das massas dos reagentes = Soma das massas dos produtos
Considere a reação entre a substância A e a substância B, que forma o produto C, como apresentado na equação a seguir:
A + B → C
Se reagirmos 10 g do reagente A com 20 g de um reagente B, obrigatoriamente, se a reação ocorrer em um sistema fechado, a massa do produto C será igual a 30g.
mA + mB = mC
10 + 20 = mC
mC = 30g
b) Lei das proporções definidas de Proust (Lei de Proust)
Foi proposta pelo químico e farmacêutico francês Joseph Louis Proust no ano de 1800. Ele percebeu que os elementos que participam da composição de uma determinada substância pura sempre apresentam uma proporção em massa.
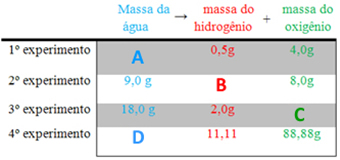
Proust afirmava que, independentemente da forma como uma substância é formada, a sua composição química é sempre a mesma. Considere como exemplo a produção de ácido clorídrico (HCl) a partir de gás cloro (Cl2) e gás hidrogênio (H2):
Gás cloro + gás hidrogênio → ácido clorídrico
Ou
Cl2 + H2 → 2HCl
Em um primeiro experimento, utilizamos 71 g de Cl2 com 2 g de H2, obtendo 73 g de HCl. Já em um segundo experimento, utilizamos 142g de Cl2 com 4 g de H2, formando 146 g de HCl. Por fim, em um terceiro experimento, utilizamos 213 g de Cl2 com 6 g de H2, formando 219g de HCl, como na tabela a seguir:
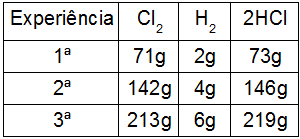
De acordo com as proporções constantes da Lei de Proust, quando relacionamos (dividimos) as massas dos reagentes de cada experimento, percebemos que, para formar ácido clorídrico, a proporção é sempre de 2 para 71:
-
1ª: 2
71 -
2ª: 4 , simplificados por 2, resultam em 2
142 71 -
3ª: 6 , simplificados por 3, resultam em 2
213 71Não pare agora... Tem mais depois da publicidade ;)
Outra observação que pode ser feita com a lei das proporções de Proust é que, quando realizamos vários experimentos para a formação de uma mesma substância, a relação entre as massas utilizadas para um mesmo participante sempre resulta no mesmo valor, como podemos observar dividindo as massas da primeira pela segunda experiência do exemplo:
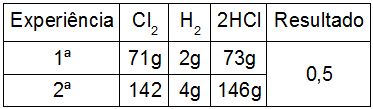
c) Lei das proporções múltiplas de Dalton
Foi proposta em 1803 pelo químico inglês John Dalton. De acordo com Dalton, quando combinamos, em uma reação química, uma mesma massa de um elemento com diferentes massas de outro elemento, o resultado é a formação de diferentes substâncias, mas a relação (divisão) das massas que variam resulta em números inteiros e pequenos.
Para exemplificar a Lei de Dalton, vamos utilizar a formação de óxidos do elemento nitrogênio. Para essa formação, utilizamos o gás nitrogênio (N2) e o gás oxigênio (O2). Para tal, devemos manter a massa do nitrogênio constante e variar a massa do oxigênio, como no quadro a seguir:
N2 + 1/2O2 → N2O
Essa é a reação-padrão entre o nitrogênio e o oxigênio, ou seja, forma-se um óxido com 2 átomos de nitrogênio e 1 átomo de oxigênio. Se variarmos a massa de oxigênio, mantendo a de nitrogênio, em experiências diferentes, o resultado será:
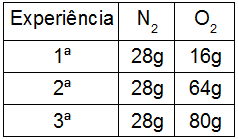
-
Dividindo a massa da 2ª experiência pela 1ª:
64 = 4
16
Houve uma variação de 1 oxigênio para 4 oxigênios entre a 1ª e a 2ª, resultando em um óxido com 4 oxigênios (N2O4).
-
Divisão da massa da 3ª experiência pela 1ª
80 = 5
16
Houve uma variação de 1 oxigênio para 5 oxigênios entre a 1ª e a 3ª, resultando em um óxido com 5 oxigênios (N2O5).
Por Me. Diogo Lopes Dias