O nitrato de amônio é uma substância sólida de fórmula molecular NH4NO3 e aspecto branco (quando puro). Constituído pelos íons NH4+ (amônio) e NO3- (nitrato), não é inflamável, mas é altamente oxidante e reativo. Sua reação de decomposição gera como produto um grande volume de gases, o que torna o armazenamento inadequado desse produto um grave problema, pois podem ocorrer explosões. É também muito utilizado na agricultura como fertilizante.
Leia também: Substâncias naturais – moléculas originadas a partir da natureza
Tópicos deste artigo
- 1 - O que é o nitrato de amônio?
- 2 - Características do nitrato de amônio
- 3 - Fórmula do nitrato de amônio
- 4 - Decomposição do nitrato de amônio
- 5 - Produção do nitrato de amônio
- 6 - Usos do nitrato de amônio
- 7 - Riscos do nitrato de amônio
O que é o nitrato de amônio?

O nitrato de amônio é um sal constituído pelos íons NH4+ (amônio) e NO3- (nitrato). É um composto sólido que, quando puro, tem coloração branca. É muito utilizado como fertilizante agrícola, mas também pode ser aplicado na fabricação de explosivos, pois é uma substância muito oxidante, logo comburente. A reação desenfreada do nitrato de amônio gera uma alta liberação de gases, causando impacto explosivo.
Características do nitrato de amônio
-
Massa molar: 80.04336 g/mol.
-
Sal composto pelos íons: amônio (NH4+) e nitrato (NO3-).
-
Aspecto: sólido branco.
-
É forte oxidante.
Não pare agora... Tem mais depois da publicidade ;) -
Reage facilmente com outras substâncias.
-
Não é inflamável.
-
Para condições normais de temperatura e pressão:
- densidade: 1,73 g/cm³;
- ponto de ebulição: 210 °C;
- ponto de fusão: 169,6 ° C;
- grau de solubilidade em água: 216 g/100ml;
- pH: 5,5 (0,2M).
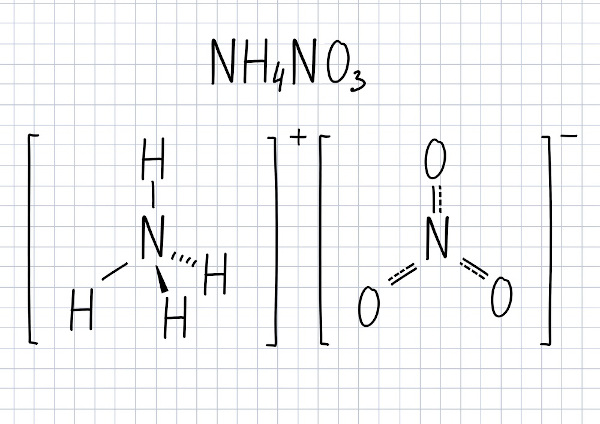
Fórmula do nitrato de amônio
A fórmula molecular desse composto é NH4NO3.
Decomposição do nitrato de amônio
Por ser uma substância de alta reatividade e de alto potencial oxidante, o nitrato de amônio, quando submetido à alta temperatura, desencadeia uma reação de decomposição, e os principais produtos são gases, nitrogênio, oxigênio e vapor de água. A decomposição é dada em duas etapas:
→ 1ª etapa:
2NH4NO3 (s) → 2N2O(g) + 4H2O(g)
→ 2ª etapa:
2N2O → 2N2(g) + O2(g)
→ Equação global:
2NH4NO3 (s) → 2N2(g) + O2(g) + 4H2O(g)
Perceba que, na primeira equação, um dos produtos obtidos na decomposição é o óxido nitroso (N2O), conhecido também como gás hilariante. Ele é utilizado para aumentar a potência de motores automotivos na queima de combustível e como anestésico, principalmente por dentistas. Também é um dos principais gases responsáveis pelo efeito estufa.
Veja também: Quais são os tipos de reações químicas?
Produção do nitrato de amônio
O nitrato de amônio pode ser obtido pela reação entre sulfato de amônio (NH4)2SO4 e nitrato de cálcio Ca(NO3)2. Veja a seguir:
(NH4)2SO4 + Ca(NO3)2 → 2 NH4NO3+ CaSO4
Também pode ser produzido a partir da amônia gasosa, que é borbulhada em solução de ácido nítrico, tendo como produto da reação o nitrato de amônio aquoso. Veja:
NH3(g) + HNO3(aq) → NH4NO3(aq)
Usos do nitrato de amônio

- Fabricação de fertilizantes
- Explosivos em minas, pedreiras e na construção civil
- Herbicidas e inseticidas
- Obtenção de óxido nitroso para aplicação industrial
- Absorventes para óxidos
- Oxidante para propulsores em foguetes
- Fabricação de sacos isotérmicos
- Produção de uma fumaça anestésica para o manejo de colmeias na apicultura
Acesse também: Como combater um incêndio?
Riscos do nitrato de amônio
Um dos principais riscos associados ao nitrato de amônio está no armazenamento inadequado. Como se trata de uma substância muito oxidante e que reage com diversos outros compostos, ele desencadeia uma reação com a liberação de um grande volume de gás. O armazenamento inadequado está sujeito à contaminação com produtos inflamáveis, exposição a calor ou retenção de gases, o que pode causar explosões.
Isso já ocorreu no Texas, nos Estados Unidos, por exemplo, com um navio cargueiro que vinha da França transportando 2.086 toneladas de nitrato de amônio. O acidente aconteceu em 1947 e ficou conhecido como o Desastre de Texas City. A tragédia causou a morte de 581 pessoas e ocorreu devido a um incêndio não contido no navio que alcançou a carga de amônio, desencadeando a explosão.
Outro exemplo foi a sequência de explosões que aconteceu em 4 de agosto de 2020 no porto da cidade de Beirute, no Líbano, deixando mais de 100 pessoas mortas e 5.000 feridas. A magnitude da explosão se deu pela ignição de uma reação em cadeia da carga de 2.750 toneladas de nitrato de amônio ali armazenada.
Vale destacar também que o nitrato de amônio pode causar irritação na pele e nos olhos e, se inalado, problemas respiratórios. Na corrente sanguínea, a substância tem poder tóxico, pois reage com os líquidos do organismo, e os produtos dessa reação, como o nitrato, podem desencadear danos à saúde, como a doença do bebê azul, também conhecida como metemoglobinemia infantil (baixa concentração de hemoglobina no sangue). Essa doença é recorrente em famílias da zona rural devido à contaminação com nitrato de amônio, presente nos fertilizantes, dos corpos d’água da região de lavouras.
Por Laysa Bernardes
Professora de Química
