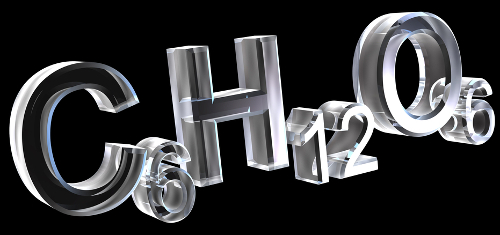Isomeria é um fenômeno natural em que substâncias diferentes (com relação às propriedades químicas e físicas) apresentam exatamente a mesma fórmula molecular, como no exemplo a seguir:
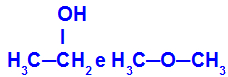
Substâncias diferentes que apresentam a mesma fórmula molecular
O etanol (à esquerda) apresenta a fórmula molecular C2H6O, o que também ocorre com o metoxietano (à direita), logo, eles são isômeros.
Tipos de Isomeria
É o tipo de isomeria que estuda as diferenças estruturais entre os isômeros.
a) Função
É o tipo de isomeria plana no qual a diferença entre as substâncias está pautada na diferença entre as funções orgânicas às quais elas pertencem. Veja alguns exemplos:
-
Propanona e propanal:
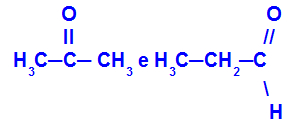
Isômeros que pertencem a diferentes funções
A propanona (à esquerda) pertence ao grupo das cetonas, e o propanal (à direita) pertence ao grupo dos aldeídos.
b) Cadeia
É o tipo de isomeria plana no qual a diferença entre as substâncias está pautada na diferença entre as cadeias que elas apresentam. Veja um exemplo:
-
2-metil-propano e butano
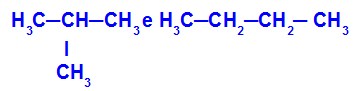
Isômeros que apresentam cadeias com diferentes classificações
No exemplo, podemos observar que o 2-metil-propano (à esquerda) apresenta cadeia ramificada, e o butano (à direita) apresenta cadeia normal.
c) Posição
É o tipo de isomeria plana no qual a diferença entre as substâncias está pautada na diferença de posição de um componente presente em suas cadeias. Veja um exemplo:
-
1-cloro-propano e 2-cloro-propano
Não pare agora... Tem mais depois da publicidade ;)
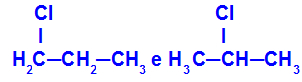
Isômeros que apresentam componentes em diferentes posições na cadeia
No exemplo, podemos observar que o 1-cloro-propano (à esquerda) apresenta o cloro posicionado no carbono 1, e o 2-cloro-propano (à direita) apresenta o cloro posicionado no carbono 2.
OBS.: Isomeria válida exclusivamente para cadeias heterogêneas.
É o tipo de isomeria plana no qual a diferença entre as substâncias está pautada na diferença de posição de um heteroátomo presente em suas cadeias. Veja um exemplo:
Exemplo: Metoxipropano e Etoxietano
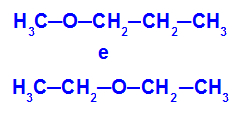
Isômeros que apresentam heteroátomos em diferentes posições na cadeia
No exemplo, podemos observar que, no metoxipropano (à esquerda), o oxigênio apresenta um radical com um carbono de um lado e três carbonos do outro. No etoxietano (à direita), o oxigênio apresenta um radical com dois carbonos de um lado e dois carbonos do outro.
É um caso particular de isomeria plana de função e ocorre em apenas três funções orgânicas:
Esse tipo de isomeria trabalha o fato de que existe um equilíbrio químico entre um enol e um aldeído e entre um enol e uma cetona, ou seja, esses componentes convertem-se um no outro constantemente. Veja um exemplo:
-
Prop-2-en-1-ol e propanona
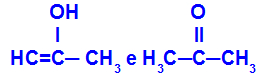
Isômeros que pertencem a diferentes funções
No exemplo, podemos observar que o Prop-2-en-1-ol (à esquerda) pertence ao grupo dos enóis, e a propanona (à direita) pertence ao grupo das cetonas, logo, são isômeros de tautomeria.
→ Isomeria espacial
É um tipo de isomeria definido pela análise espacial da molécula.
a) Isomeria geométrica
É um tipo de isomeria espacial que ocorre quando a substância apresenta moléculas com as seguintes características:
-
Cadeia fechada que possua dois carbonos com dois ligantes diferentes entre si, como no exemplo abaixo:
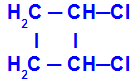
Estrutura fechada com isomeria geométrica
-
Cadeia aberta que apresente uma ligação dupla entre carbonos e, em cada um desses carbonos da ligação dupla, haja dois ligantes diferentes, como no exemplo abaixo:
Não pare agora... Tem mais depois da publicidade ;)
![]()
Estrutura aberta com isomeria geométrica
A isomeria geométrica é dividida em dois grupos:
-
1o Grupo: Cis-trans
Ocorre quando os dois ligantes de um carbono são rigorosamente iguais aos dois ligantes do outro carbono, seja na estrutura aberta, seja na estrutura fechada.
![]()
Cadeia de uma substância que apresenta isomeria cis-trans
O isômero será chamado de cis quando os ligantes iguais estiverem no mesmo plano.
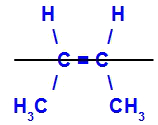
Exemplo de um isômero cis
O isômero será chamado de trans quando os ligantes diferentes estiverem no mesmo plano.
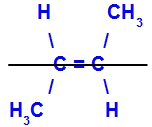
Exemplo de um isômero trans
-
2o Grupo: E-Z
Ocorre quando os dois ligantes de um carbono são diferentes com relação aos dois ligantes do outro carbono, seja na estrutura aberta, seja na estrutura fechada.
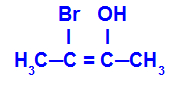
Cadeia de uma substância que apresenta isomeria E-Z
O isômero será chamado de E quando os ligantes de maior número atômico estiverem em planos opostos. No exemplo abaixo, o carbono da esquerda tem o Br com maior número atômico (35) e, no outro, há o oxigênio (8).
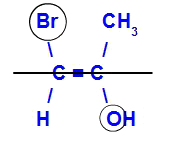
Exemplo de um isômero E
O isômero será chamado de Z quando os ligantes de maior número atômico estiverem no mesmo plano. No exemplo abaixo, o carbono da esquerda tem o Br com maior número atômico (35) e, no outro, há o oxigênio (8).
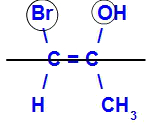
Exemplo de um isômero Z
É um tipo de isomeria espacial que ocorre apenas se a substância apresentar moléculas com carbono quiral (aquele que possui quatro ligantes diferentes) em suas estruturas. A molécula com carbono quiral apresenta a capacidade de polarizar e desviar a luz, da seguinte forma:
-
Para a direita (isômero dextrogiro)
-
Para a esquerda (isômero levogiro)
Um composto com atividade óptica sempre apresenta isômeros ativos (chamados de antípodas ópticas) e isômeros inativos (mistura entre dois isômeros ativos, mistura essa chamada de racêmica).
Podemos utilizar a fórmula a seguir para determinar o número de isômeros ativos (IOA) e inativos (IOI) de um composto que apresente carbono quiral:
IOA = 2n
IOI = 2n
2
Abaixo temos um exemplo de composto que apresenta isomeria geométrica:
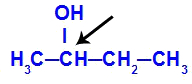
Carbono quiral em destaque no butan-2-ol
A estrutura do butan-2-ol apresenta os seguintes ligantes:
-
Metil (CH3)
-
Etil (CH3-CH2)
-
Hidrogênio (H)
Não pare agora... Tem mais depois da publicidade ;) -
Hidroxila (OH)
Por ter apenas um carbono quiral, logo, o butan-2-ol apresenta:
-
Isômeros ativos:
IOA = 21
IOA = 2
-
Isômeros inativos:
Não pare agora... Tem mais depois da publicidade ;)
IOI = 21
2
IOI = 2
2
IOI = 1
Por Me. Diogo Lopes Dias