Isomeria geométrica é um tipo de isomeria espacial que avalia e compara a posição no espaço dos ligantes de dois átomos de carbono em uma cadeia. Essa avaliação é feita a partir de um plano imaginário entre os carbonos envolvidos.
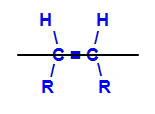
Plano imaginário dividindo a molécula
O plano imaginário na estrutura acima divide a molécula em um plano superior e um plano inferior. Com isso, podemos avaliar e comparar os ligantes dos carbonos envolvidos em cada um desses planos. Veja os tipos de isomeria geométrica:
→ Isomeria geométrica cis-trans
Um composto apresenta isomeria geométrica cis-trans quando a cadeia apresenta:
-
Cadeia aberta com uma dupla ligação entre dois carbonos, que apresentam os mesmos ligantes entre si. Veja um exemplo:
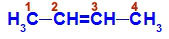
Fórmula estrutural do But-2-eno
Na estrutura, podemos observar que tanto o carbono 2 quanto o carbono 3 apresentam os mesmos ligantes, que são o hidrogênio (H) e o metil (CH3).
-
Cadeia fechada com dois carbonos que apresentam os mesmos ligantes entre si. Veja um exemplo:
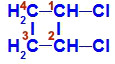
Fórmula estrutural do 1,2-dicloro-ciclobutano
Na estrutura, podemos observar que tanto o carbono 1 quanto o carbono 2 apresentam os mesmos ligantes, que são o hidrogênio (H) e o cloro (Cl).
Para explicar a isomeria cis-trans, utilizaremos o but-2-eno:
a) Isômero cis: é o isômero geométrico em que os ligantes iguais ocupam o mesmo plano. No exemplo a seguir, os hidrogênios estão no mesmo plano, o que também ocorre com os radicais metil.
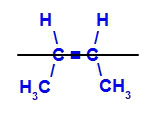
Fórmula estrutural do cis-but-2-eno
b) Isômero trans: é o isômero geométrico em que ligantes diferentes ocupam o mesmo plano. No exemplo a seguir, temos no mesmo plano um hidrogênio e um metil (CH3).
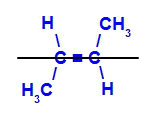
Fórmula estrutural do trans but-2-eno
Um composto apresenta isomeria geométrica E-Z quando a cadeia apresenta:
-
Cadeia aberta com uma dupla ligação entre dois carbonos, que apresentam todos ou alguns ligantes diferentes entre si. Veja um exemplo:
Não pare agora... Tem mais depois da publicidade ;)
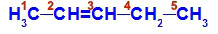
Fórmula estrutural do pent-2-eno
Na estrutura, podemos observar que o carbono 2 apresenta o ligante metil (CH3) e hidrogênio (H), e o carbono 3 apresenta o ligante hidrogênio (H) e etil (H3C-CH2).
-
Cadeia fechada com dois carbonos que apresentam todos ou alguns ligantes diferentes entre si. Veja um exemplo:
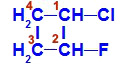
Fórmula estrutural do 1-cloro-2-flúor-ciclobutano
Na estrutura, podemos observar que o carbono 1 apresenta o hidrogênio e o cloro como principais ligantes, e o carbono 2 apresenta hidrogênio e o flúor como principais ligantes.
OBS.: Entre os ligantes diferentes, na isomeria geométrica, avaliamos a complexidade do ligante (quantidade de átomos) ou o número atômico.
Para explicar a isomeria E-Z, utilizaremos tanto o pent-2-eno quanto o 1-cloro-2-flúor-ciclobutano:
a) Isômero E
Isômero geométrico em que os ligantes mais complexos ou de maior número atômico estão posicionados em planos opostos. No exemplo a seguir, o ligante mais complexo do carbono 2 é o metil, e o ligante mais complexo do carbono 3 é o etil, os quais estão posicionados em planos diferentes.
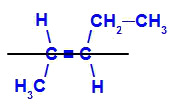
Fórmula estrutural do E- pent-2-eno
b) Isômero Z
Isômero geométrico em que os ligantes mais complexos ou de maior número atômico estão posicionados no mesmo plano. No exemplo a seguir, o ligante de maior número atômico do carbono 1 é o cloro (Z = 17), e o ligante de maior número atômico do carbono 2 é o flúor (Z = 9), os quais estão posicionados no mesmo plano.
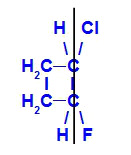
Fórmula estrutural do Z-1-cloro-2-flúor-ciclobutano
Por Me. Diogo Lopes Dias