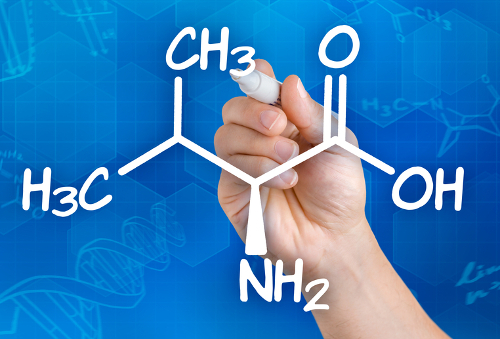
Isomeria óptica é um tipo de isomeria espacial que tem como principal objetivo estudar o comportamento de moléculas que apresentam assimetria, ou seja, que não se sobrepõem umas às outras.

Imagem especular da mão esquerda
Moléculas que não são sobreponíveis (moléculas assimétricas) podem ser comparadas à mão direita e sua imagem especular. Na imagem acima, temos que a imagem especular da mão esquerda é a mão direita, as quais não se sobrepõem.
As principais diferenças entre moléculas que apresentam isomeria óptica estão na influência que causam ou não na luz polarizada, sendo capazes de desviar ou não a luz, e com relação às propriedades físicas e químicas que apresentam.
Para afirmar que uma substância apresenta isomeria óptica, devemos buscar em suas moléculas a presença de pelo menos um carbono assimétrico (também denominado de carbono quiral), que é um carbono que apresenta quatro ligantes diferentes, como no exemplo a seguir:
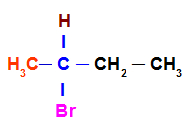
Carbono com quatro ligantes diferentes
O carbono acima apresenta os ligantes hidrogênio (H), metil (CH3), bromo (Br) e etil (H3C-CH2) e, por isso, é um carbono quiral.
Veja agora os tipos de isômeros estudados na Isomeria Óptica:
Isômeros ópticos ativos
Também chamados de antípodas ópticas, enantiomorfos ou moléculas quirais, são moléculas orgânicas que apresentam a capacidade de desviar o sentido da luz polarizada para a esquerda ou para a direita.
A molécula de um composto orgânico que é capaz de desviar a luz para a direita é denominada de dextrogira. Já a molécula do mesmo composto orgânico que é capaz de desviar a luz para a esquerda é denominada de levogira.
Todo composto orgânico que apresenta um carbono quiral automaticamente apresenta uma molécula dextrogira e uma molécula levogira. Porém, se um determinado composto orgânico apresentar mais de um carbono quiral, temos que utilizar a fórmula proposta pelo cientista Van't Hoff para determinar o número de moléculas dextrogiras e levoriras. Veja:
IOA = 2C
-
IOA = isômeros opticamente ativos;
-
C = número de carbonos quirais na molécula.
Isômeros ópticos inativos
Também chamados de mistura racêmica, nos isômeros ópticos inativos, temos a presença de um mesmo número de moléculas dextrogiras e levogiras em um recipiente. Essa mistura não apresenta a capacidade de desviar o sentido da luz polarizada nem para a esquerda nem para a direita.
De acordo com a regra proposta pelo cientista Van't Hoff, para determinar o número de misturas racêmicas formadas por um composto orgânico, basta utilizar a seguinte expressão:
IOI = 2C
2
-
IOI = isômeros opticamente inativos;
-
C = número de carbonos quirais na molécula.
Isômero meso
Isômero meso é a molécula que apresenta dois carbonos quirais iguais, ou seja, ambos os carbonos apresentam os mesmos quatro ligantes, como no exemplo a seguir:
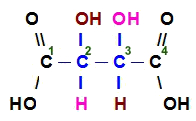
O ácido tartárico apresenta isômero meso
Os ligantes dos carbonos 2 e 3 são exatamente os mesmos: uma hidroxila (OH), uma carboxila (COOH), um hidrogênio (H) e o grupo carbo-hidróxi-carboxila (CHOHCOOH).
Como o isômero meso possui dois carbonos quirais iguais, o efeito que um desses carbonos provoca na luz polarizada é anulado pelo efeito provocado pelo outro carbono. Dessa forma, trata-se de um isômero opticamente inativo.
Por Me. Diogo Lopes Dias