Denomina-se de modelo de Rutherford a proposta feita para o átomo pelo cientista Ernest Rutherford no ano de 1911, com o objetivo de demonstrar a forma e a composição idealizadas do constituinte da matéria: o átomo.
O modelo de Rutherford é comumente conhecido como o modelo do sistema solar, já que sua estrutura e funcionamento foram comparados à relação entre o sol e os planetas que giram à sua volta.
Em seu modelo, Rutherford comparou o sol ao núcleo do átomo, e os elétrons do átomo foram comparados aos planetas do sistema solar, como podemos observar na seguinte representação:
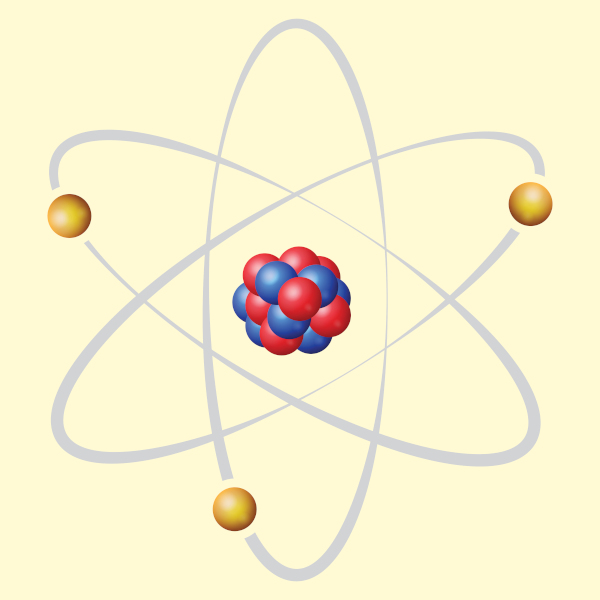
No interior do núcleo, estariam posicionadas as partículas de carga positiva, denominadas prótons (descobertas por Eugen Goldstein). Esse núcleo seria pequeno e denso e apresentaria a maior massa do átomo.
Tópicos deste artigo
O experimento realizado por Rutherford
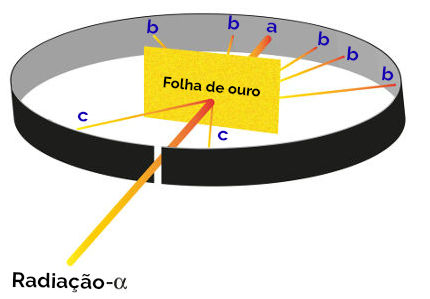
Todas as propostas de Rutherford para a criação do seu modelo atômico foram resultado de um experimento em que ele incidiu feixes de radiação alfa (oriundos de polônio radioativo presente em uma caixa de chumbo) sobre uma fina lâmina de ouro, com uma placa de metal coberta de sulfeto de zinco atrás e nas laterais. O sulfeto de zinco é um sal que, ao receber radiação, brilha.
Rutherford, então, observou que três pontos (a, b, c), em especial, brilharam durante esse experimento:
-
Ponto a (maior incidência de brilho): indicava que a radiação alfa atravessou a lâmina de ouro sem problema algum, pois estaria na direção do orifício de abertura do bloco de chumbo;
-
Ponto b (pequena incidência de brilho): indicava que a radiação alfa atravessou a lâmina de ouro, mas que teria sofrido desvios durante a travessia;
-
Ponto c (uma quantidade extremamente pequena de brilho): localizado à frente da lâmina de ouro, indicava que radiação alfa não atravessou.
Rutherford atribuiu esses resultados observados aos átomos que formam a lâmina de ouro, interpretando da seguinte forma:
-
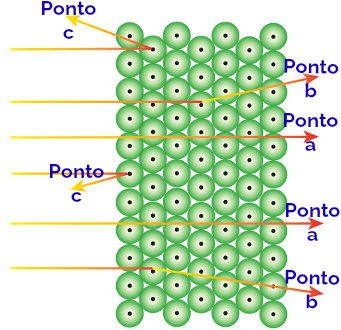
Radiação alfa que atinge o ponto a: a radiação alfa é positiva e passa por uma região do átomo de imensos espaços vazios. Também há a presença de elétrons em alguns orbitais.
-
Radiação alfa que atinge o ponto b: a radiação alfa atravessa os átomos da lâmina de ouro, porém chega a um determinado momento em que ela passa próxima do pequeno núcleo do átomo, que é carregado positivamente, gerando repulsão na radiação.
-
Radiação alfa que atinge o ponto c: a radiação alfa atravessa os átomos da lâmina de ouro, porém atingem em cheio um pequeno núcleo, que é carregado positivamente, gerando repulsão na radiação.
Problemáticas do modelo de Rutherford
Muitos físicos apontaram alguns problemas no modelo proposto por Rutherford:
-
1º problema: como seria possível um núcleo carregado positivamente, se partículas de carga positiva repelem-se?
-
2º problema: por que os elétrons nas eletrosferas não são atraídos pelos prótons no núcleo?
-
3º problema: por que os elétrons, que são pequenos corpos em constante movimento, não perdem energia e caem no núcleo?