As substâncias são aqueles materiais com composição química constante e que possuem suas propriedades físicas bem definidas, tais como os pontos de fusão e ebulição e a densidade, não variando em determinada temperatura e pressão.
A água destilada usada em laboratórios, por exemplo, é uma substância pura formada apenas por moléculas de H2O (esta é a sua composição química constante) e, sob pressão de 1 atm (ao nível do mar), ela sempre terá ponto de fusão igual a 0ºC, ponto de ebulição igual a 100 ºC e densidade de 1,0 g/mL a 4ºC. Veja mais dois exemplos:
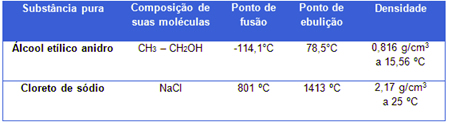
Propriedades físicas do álcool e do cloreto de sódio
Existem dois tipos de substâncias, as simples e as compostas:
São aquelas cujas moléculas são formadas apenas por um único tipo de elemento químico. Os átomos dos elementos podem aparecer na forma isolada, sendo substâncias monoatômicas, ou formar moléculas diatômicas e triatômicas. Exemplos:
-
Monoatômicas: é o caso do gás hélio (He), um gás nobre que aparece isolado na natureza, e também do ferro (Fe) e do alumínio (Al), que são metais. Veja o texto Ligação Metálica para entender como os átomos desses elementos permanecem unidos;
-
Diatômicas: o gás oxigênio presente no ar atmosférico é constituído por moléculas formadas cada uma por dois átomos de oxigênio, O2, e as moléculas de gás hidrogênio são formadas por dois átomos de hidrogênio, H2;
-
Triatômicas: o gás ozônio é formado por três átomos de oxigênio, O3.
São aquelas cujas moléculas, ou aglomerados iônicos, são formados por dois ou mais elementos químicos ou íons. A água, o álcool e o cloreto de sódio, mencionados anteriormente, são todos classificados como substâncias compostas ou compostos químicos, pois eles são formados por diferentes elementos (hidrogênio, oxigênio, carbono, sódio e cloro).
Outros exemplos: dióxido de carbono (CO2), monóxido de carbono (CO), metano (CH4) e amônia (NH3).
As substâncias compostas podem ser decompostas em substâncias simples. Por exemplo, ao passarmos uma corrente elétrica sobre o cloreto de sódio fundido, ocorrerá uma reação de oxirredução que dará origem a duas substâncias simples, o sódio metálico (Na(s)) e o gás cloro (Cl2(g)). Esse processo é conhecido como Eletrólise Ígnea do Cloreto de Sódio.
Por Jennifer Fogaça
Graduada em Química


