Substância pura e mistura são duas formas de se classificar a matéria. As substâncias puras são formadas por um único tipo de elemento químico (ou moléculas), tendo propriedades físicas e químicas definidas e constantes. A água destilada, o ouro e o oxigênio são exemplos de substâncias puras. As misturas, por sua vez, são formadas por duas ou mais substâncias puras, podendo ser homogêneas (com aspecto uniforme, como o ar atmosférico) ou heterogêneas (com fases distintas visíveis, como a água e o óleo). As propriedades de uma mistura variam de acordo com a proporção de seus componentes.
A principal diferença entre substâncias puras e misturas reside em suas propriedades. Enquanto as substâncias puras apresentam ponto de fusão e ebulição constantes, densidade fixa e outras características invariáveis, as misturas têm propriedades que podem variar de acordo com a sua composição.
Leia também: Quais são os métodos de separação de misturas?
Tópicos deste artigo
- 1 - Resumo sobre substâncias puras e misturas
- 2 - Videoaula sobre substâncias puras e misturas
- 3 - O que são substâncias puras?
- 4 - Substâncias puras simples e compostas
- 5 - O que são misturas?
- 6 - Tipos de misturas
- 7 - Características das substâncias puras
- 8 - Características das misturas
- 9 - Exercícios sobre substâncias puras e misturas
Resumo sobre substâncias puras e misturas
- Substâncias puras têm uma composição química constante, podendo ser classificadas em simples e compostas.
- Substância simples é formada por átomos de um único elemento químico.
- Substância composta é formada por átomos de dois ou mais elementos químicos diferentes.
- Mistura é a combinação de duas ou mais substâncias puras sem que ocorra uma reação química entre elas.
- Mistura homogênea é aquela em que os componentes se misturam de maneira uniforme, formando uma única fase visível.
- A mistura heterogênea não apresenta componentes distribuídos uniformemente, sendo possível identificar mais de uma fase visível.
- Uma substância pura apresenta ponto de fusão (PF) e o ponto de ebulição (PE) fixos.
- Misturas comuns não apresentam PF e PE definidos, diferentemente das misturas eutéticas e azeotrópicas.
Videoaula sobre substâncias puras e misturas
O que são substâncias puras?
Substâncias puras são aquelas que têm uma composição química constante, ou seja, sua fórmula química é fixa. Isso significa que suas propriedades físicas e químicas também são uniformes.
Substâncias puras simples e compostas
A substância pura pode ser classificada em simples ou composta. Um exemplo de substância simples é o bromo (Br₂), um líquido avermelhado que passa facilmente para a forma de vapor. Já a água (H₂O) é um exemplo de substância pura composta, formada por dois elementos diferentes, hidrogênio e oxigênio, como mostra a ilustração abaixo.
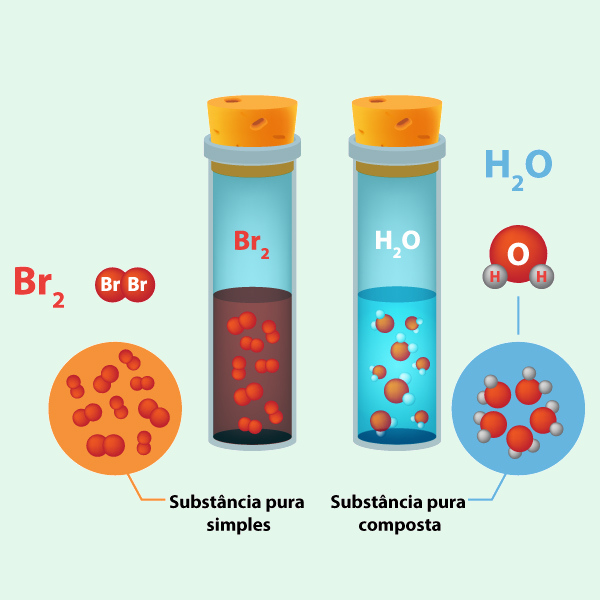
→ Substâncias puras simples
Substância pura simples é aquela formada por átomos de um único elemento químico. Isso significa que essas substâncias não podem ser decompostas em outras substâncias por processos químicos comuns. Por exemplo, o oxigênio (O₂), o nitrogênio (N₂) e o ferro (Fe) são substâncias simples presentes em nossa vida diária.
Uma característica interessante das substâncias simples é a possibilidade de formarem diferentes estruturas com base no mesmo elemento, fenômeno conhecido como alotropia. Exemplos de substâncias alotrópicas incluem o carbono, que pode se manifestar como diamante, grafite ou fulereno, e o oxigênio, que existe tanto na forma de O₂ quanto na de O₃ (ozônio).
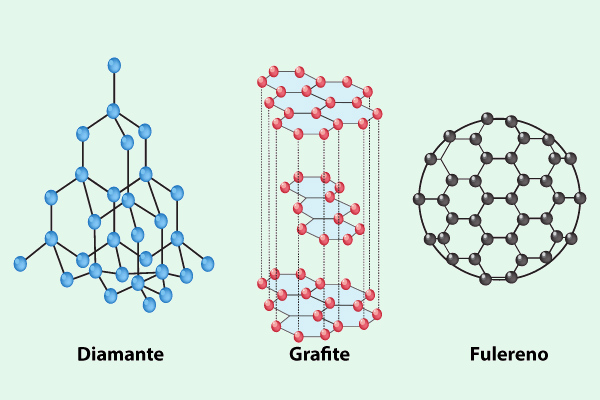
Como se observa na imagem acima, a diferente organização dos átomos de carbono influencia profundamente as propriedades físicas e químicas dos seus alótropos.
→ Substâncias puras compostas
Substância pura composta é aquela formada por átomos de dois ou mais elementos químicos diferentes, unidos por ligações químicas. Um exemplo clássico de substância composta é a água (H₂O), em que dois átomos de hidrogênio se ligam a um átomo de oxigênio. Outro exemplo comum é o dióxido de carbono (CO₂), exalado pelos seres vivos durante a respiração.
As substâncias puras compostas são essenciais para muitas reações químicas no cotidiano e na indústria, como no caso da amônia (NH₃), utilizada em fertilizantes, e do cloreto de sódio (NaCl), conhecido como sal de cozinha.
Veja também: Quais são as propriedades da matéria?
O que são misturas?
Mistura é a combinação de duas ou mais substâncias puras, sem que ocorra uma reação química entre elas. Isso significa que as substâncias que compõem a mistura mantêm suas propriedades individuais. As misturas podem ser classificadas em homogêneas e heterogêneas, dependendo da forma como os componentes estão distribuídos. Um exemplo de mistura homogênea é a dissolução de açúcar em água. Já a adição de óleo e água é um exemplo de mistura heterogênea, em que os componentes podem ser facilmente diferenciados.

Tipos de misturas
→ Misturas homogêneas
Mistura homogênea é aquela em que os componentes se misturam de maneira uniforme, formando uma única fase visível, ou seja, mesmo sob um microscópio, não é possível distinguir as diferentes substâncias presentes. A mistura de sal de cozinha e água, representada na ilustração abaixo, é um exemplo de mistura homogênea.
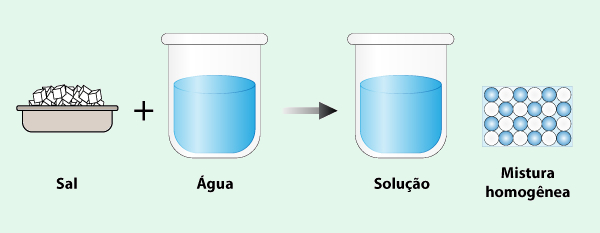
Outros exemplos de misturas homogêneas presentes no nosso cotidiano são o ar, composto por gases como oxigênio, nitrogênio e dióxido de carbono, e a mistura de álcool etílico e água, utilizada para higienização pessoal e de objetos.
A característica essencial das misturas homogêneas é que as substâncias formam uma solução cuja composição é a mesma em qualquer ponto da amostra. Um exemplo cotidiano é o soro fisiológico, utilizado em hospitais, que consiste em uma solução de cloreto de sódio e água.
→ Misturas heterogêneas
Mistura heterogênea é aquela em que os componentes não estão uniformemente distribuídos, sendo possível identificar mais de uma fase visível. Na mistura heterogênea, as substâncias não se misturam, formando camadas separadas. Um exemplo é a mistura de areia e água, em que é possível distinguir as fases da mistura, como mostra a ilustração abaixo.
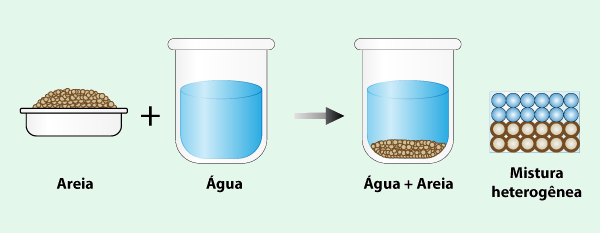
Em geral, as misturas heterogêneas podem conter sólidos, líquidos ou gases e, ao contrário das homogêneas, não apresentam uma distribuição uniforme dos componentes.
Características das substâncias puras
Uma substância pura pode ser identificada por suas propriedades físicas específicas, como o ponto de fusão (PF) e o ponto de ebulição (PE). O PF é a temperatura em que ocorre a mudança do estado sólido para o estado líquido da substância, enquanto o PE é a temperatura em que ocorre a mudança do estado líquido para o estado gasoso. Essas propriedades são fundamentais porque revelam a pureza da substância.
A água pura, por exemplo, tem um ponto de fusão de 0 °C e um ponto de ebulição de 100 °C, na pressão de 1 atm. Essas temperaturas não variam durante as mudanças de fase, ao contrário do que ocorre em misturas, nas quais as temperaturas de transição podem variar.
Ao analisarmos a transição da água entre os estados sólido (S), líquido (L) e gasoso (G), essas propriedades ficam evidentes. A curva de aquecimento de uma substância pura, como a água, pode ser representada por um gráfico de temperatura versus tempo.
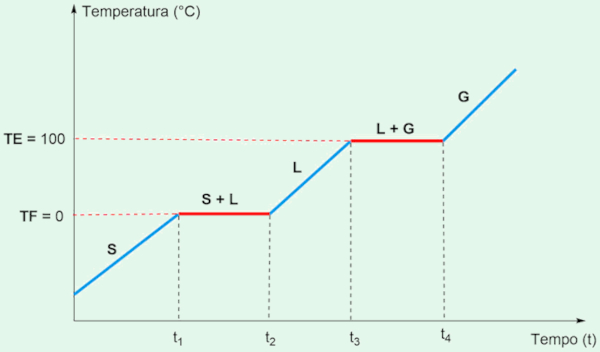
Nesse gráfico, durante a fusão, a temperatura se mantém constante em 0 °C até que todo o gelo derreta. Da mesma forma, ao atingir 100 °C, a água líquida começa a vaporizar, e a temperatura permanece constante até que toda a água se transforme em vapor.
Durante a fusão, o calor é absorvido sem elevar a temperatura, pois a energia é usada para romper as interações entre as moléculas no estado sólido. Da mesma forma, durante a ebulição, o calor permite que as moléculas se separem ainda mais, possibilitando a passagem para o estado gasoso sem variação de temperatura.
Características das misturas
As misturas, diferentemente das substâncias puras, não apresentam pontos de fusão e ebulição definidos. Em vez disso, ocorrem em faixas de temperatura, uma vez que as diferentes substâncias presentes na mistura afetam as propriedades do sistema. Ao adicionar sal de cozinha (NaCl) à água, por exemplo, a fusão e a ebulição passam a ocorrer em intervalos de temperatura, refletindo a presença de diferentes componentes.
A mistura de água e sal apresenta uma faixa de fusão abaixo de 0 °C, já que o sal interfere nas interações entre as moléculas de água, diminuindo a temperatura necessária para a fusão. Esse fenômeno, conhecido como abaixamento crioscópico, explica por que estradas são salgadas durante o inverno para evitar o congelamento.
No caso da ebulição, o ponto de ebulição da mistura será maior que 100 °C, um fenômeno conhecido como elevação ebuliométrica. A adição de sal aumenta a temperatura necessária para que as moléculas de água adquiram energia suficiente para passarem para o estado gasoso.
Em um gráfico de temperatura versus tempo para a mistura de água e sal, as transições de fase não se dão em patamares fixos, mas sim em faixas, indicando que ocorre uma variação de temperatura (ΔT).
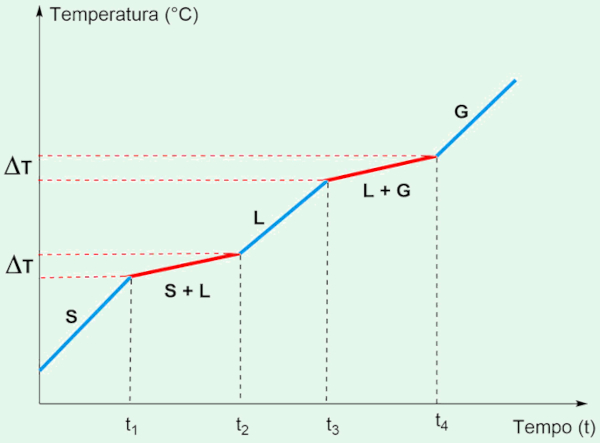
O gráfico apresentaria um aumento contínuo de temperatura durante a fusão e a ebulição. Essa variação ocorre porque a presença de um soluto (sal) modifica as interações entre as moléculas de solvente (água), exigindo mais energia para realizar a mudança de fase.
Além disso, algumas misturas podem exibir comportamentos semelhantes aos de substâncias puras em relação ao ponto de fusão ou ebulição. São as chamadas misturas eutéticas e azeotrópicas, que têm características próprias que as distinguem das misturas comuns.
→ Mistura eutética
Mistura eutética é aquela que se comporta como uma substância pura em relação ao ponto de fusão. Uma mistura eutética tem um ponto de fusão único, no qual todos os componentes da mistura fundem-se uns nos outros ou solidificam-se simultaneamente. Um exemplo clássico é a solda, uma mistura de chumbo (Pb) e estanho (Sn). Essa mistura se funde em uma temperatura constante, mesmo sendo composta por dois elementos diferentes.
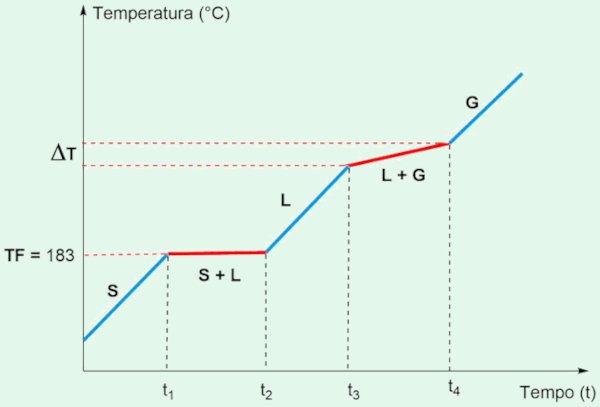
No gráfico de temperatura versus tempo para a solda, vemos um patamar, durante a fusão, similar ao de uma substância pura, em 183 °C. No entanto, na ebulição, ocorre uma elevação contínua da temperatura, indicando que a mistura está evaporando gradualmente. Esse comportamento misto — fusão em ponto fixo e ebulição em faixa — é a marca característica de uma mistura eutética.
→ Mistura azeotrópica
Mistura azeotrópica é uma mistura que se comporta como uma substância pura em relação ao ponto de ebulição. Tem um ponto de ebulição constante, no qual todos os componentes passam para a fase gasosa simultaneamente, sem separação de componentes. Um exemplo comum é a mistura de álcool etílico (etanol) e água. Na proporção de cerca de 96% de etanol e 4% de água, essa mistura tem um ponto de ebulição constante de aproximadamente 78,1°C.
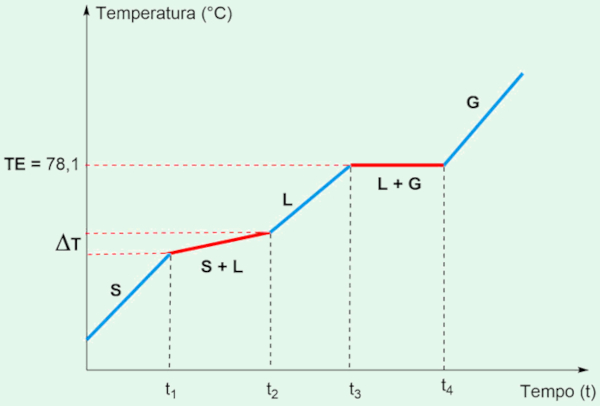
No gráfico de temperatura versus tempo para essa mistura, vemos um comportamento semelhante ao de uma substância pura durante a ebulição, com temperatura de 78,1 °C. No entanto, durante a fusão, o gráfico mostra uma faixa de temperatura em vez de um ponto fixo, refletindo a variação no ponto de fusão dos componentes. Esse comportamento — ebulição em temperatura fixa e fusão em faixa — é típico das misturas azeotrópicas.
Essas misturas têm grande importância prática, sendo utilizadas em processos de destilação fracionada na indústria, nos quais é essencial separar componentes de misturas líquidas, como na produção de bebidas alcoólicas ou solventes industriais.
Saiba mais: Quais são os estados físicos da matéria?
Exercícios sobre substâncias puras e misturas
Questão 1 (Efoa/Unifal-MG) O ferro é um dos componentes da hemoglobina. A falta de ferro na alimentação causa anemia. O processo anêmico pode ser revertido com uma alimentação rica em carnes, verduras, grãos e cereais integrais, sendo, em alguns casos, necessário um suplemento de sulfato de ferro (II). Nesse contexto, os termos sublinhados no texto acima classificam-se, respectivamente, como:
a) elemento químico e substância composta.
b) substância simples e substância composta.
c) mistura homogênea e mistura homogênea.
d) substância simples e mistura heterogênea.
e) elemento químico e mistura heterogênea.
Alternativa correta: Letra a)
O ferro presente na hemoglobina é um elemento químico. O sulfato de ferro II (FeSO4) apresenta mais de um elemento químico, logo, é uma substância composta.
Questão 2 (UFRGS-RS) Analise os sistemas materiais abaixo, estando ambos na temperatura ambiente.
Sistema I: mistura de 10 g de sal de cozinha, 30 g de areia fina, 20 mL de óleo e 100 mL de água.
Sistema II: mistura de 2,0 L de CO2, 3,0 L de N2 e 1,5 L de O2.
Sobre esses sistemas, é correto afirmar que:
a) ambos são heterogêneos, pois apresentam mais de uma fase.
b) em I, o sistema é bifásico, após forte agitação, e, em II, é monofásico.
c) em I, o sistema é trifásico, após forte agitação, e, em II, é monofásico.
d) ambos apresentam uma única fase, formando sistemas homogêneos.
e) em I, o sistema é trifásico, independentemente da ordem de adição dos componentes, e, em II, é bifásico.
Alternativa correta: Letra c)
Sistema I: sistema trifásico. Água e sal formam uma mistura homogênea, a areia fina e o óleo são insolúveis em água.
Sistema II: sistema monofásico. A mistura de gases forma um sistema homogêneo, com uma única fase.
Questão 3 (UEFS) A curva de aquecimento, representada no gráfico, mostra a variação de temperatura em função do tempo de uma amostra de álcool vendida em supermercado.
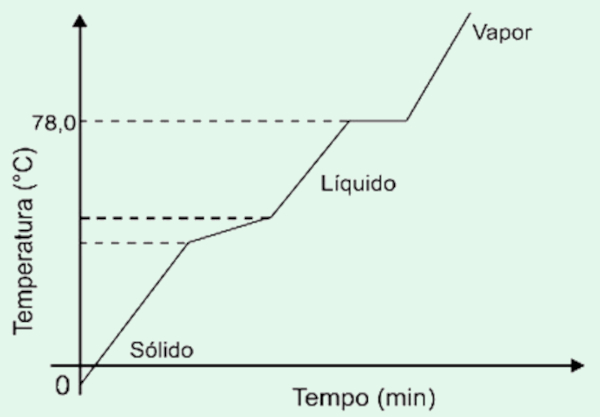
Considerando-se essas informações, uma análise desse gráfico permite corretamente afirmar:
a) O álcool da amostra é uma substância composta pura.
b) O vapor formado no final do aquecimento contém apenas etanol.
c) A temperatura de ebulição mostra que esse álcool é uma mistura azeotrópica.
d) A temperatura de ebulição constante mostra que o álcool da amostra é isento de água.
e) A temperatura de fusão variável mostra que o álcool vendido em supermercado é uma mistura eutética.
Alternativa correta: Letra c)
O gráfico mostra que a fusão é variável e o ponto de ebulição é constante. Essas características são de uma mistura azeotrópica.
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.
BELLAS, Renata R. D., QUEIROZ, Indman R. L., LIMA, Luiza R. F. C., SILVA, José Luis P. B. O conceito de substância química e seu ensino. Quím. nova esc, 41, 1, 17-24, 2019





