Propriedades da matéria são características que permitem identificar, classificar e descrever a matéria em diferentes contextos. Essas propriedades podem ser agrupadas em físicas, químicas, organolépticas e funcionais, e refletem a composição e a estrutura dos constituintes da matéria. A origem dessas propriedades está diretamente relacionada aos átomos, moléculas e partículas que formam a matéria, bem como às interações entre elas.
Leia também: Quais são os estados físicos da matéria?
Tópicos deste artigo
- 1 - Resumo sobre propriedades da matéria
- 2 - Videoaula sobre propriedades da matéria
- 3 - Quais são as propriedades da matéria?
- 4 - Importância das propriedades da matéria
- 5 - Experiências sobre propriedades da matéria
Resumo sobre propriedades da matéria
- As propriedades da matéria são divididas em propriedades gerais e propriedades específicas.
- As propriedades gerais são: massa, extensão, volume, inércia, impenetrabilidade, divisibilidade, compressibilidade, elasticidade, indestrutibilidade, descontinuidade.
- As propriedades específicas se subdividem em quatro tipos:
- Físicas (não alteram a composição da matéria): ponto de fusão (PF), ponto de ebulição (PE), densidade, solubilidade, condutividade elétrica, maleabilidade, ductibilidade, magnetismo, dureza e viscosidade.
- Químicas (se manifestam durante uma reação química): combustibilidade, reatividade, oxidação, corrosividade.
- Organolépticas (relacionadas aos sentidos): cor, odor, sabor, textura e som.
- Funcionais (relacionadas às funções das substâncias): ácidos, bases, sais e óxidos.
Videoaula sobre propriedades da matéria
Quais são as propriedades da matéria?
As propriedades da matéria são características que definem e identificam qualquer tipo de matéria. Elas são divididas em propriedades gerais e específicas.
As propriedades gerais são: massa, extensão, volume, inércia, impenetrabilidade, divisibilidade, compressibilidade, elasticidade, indestrutibilidade e descontinuidade.
As propriedades específicas são divididas em:
-
físicas;
-
químicas;
-
organolépticas;
-
funcionais.
→ Propriedades gerais da matéria
As propriedades gerais são comuns a todos os tipos de matéria e não permitem diferenciar substâncias. Essas propriedades são:
-
Massa: é a quantidade de matéria que um corpo tem. A massa é uma grandeza escalar medida em unidades do Sistema Internacional (SI), como o grama (g) e o quilograma (kg).
-
Extensão: é o espaço ocupado por um corpo. A extensão está intimamente relacionada com o volume.
-
Volume: é a medida quantitativa do espaço ocupado pela matéria. Essa grandeza é tridimensional, pois considera a altura, largura e profundidade do objeto. A unidade de medida do volume no SI é o metro cúbico (m³), porém outras unidades, como o litro (L) e o centímetro cúbico (cm³), são comumente utilizadas.
-
Inércia: é a tendência de um corpo manter seu estado de movimento ou repouso. Essa propriedade depende diretamente da massa. Isso significa que, quanto maior for a massa, maior será a inércia de um corpo. Essa propriedade é percebida facilmente no cotidiano diante de freadas bruscas de veículos, como mostra a imagem abaixo.

-
Impenetrabilidade: indica que dois corpos não podem ocupar o mesmo lugar no espaço ao mesmo tempo. Isso é observado ao mergulhar um objeto em um recipiente com água, que gera um deslocamento na massa de água, como mostra a imagem abaixo.

-
Divisibilidade: a matéria pode ser dividida em partes cada vez menores.
-
Compressibilidade: a maioria dos corpos pode ter seu volume diminuído pela aplicação de força. Um exemplo é a compressão de gases em cilindros, como ilustra a imagem abaixo, em que o volume (V) do gás vária por ação de uma força externa (p). Essa variação é visualizada por meio da variação de altura (Δh).
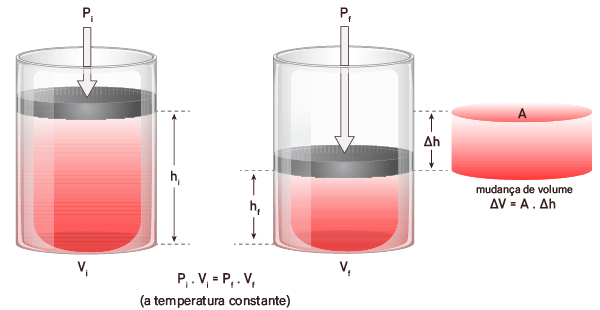
-
Elasticidade: capacidade de um corpo retornar à sua forma original após sofrer deformação. Um exemplo comum dessa propriedade são as molas, que podem ser esticadas, mas voltam à sua forma inicial ao ser solta.

-
Indestrutibilidade: a matéria não pode ser criada nem destruída, apenas transformada. Esse é o enunciado da lei da conservação da massa, proposta por Antoine Lavoisier. Essa lei fundamental pode ser ilustrada por meio da reação de combustão do metano (CH4), que, ao reagir com o gás oxigênio (O2), se transforma em gás carbônico (CO2) e água (H2O), como ilustra a imagem a seguir.
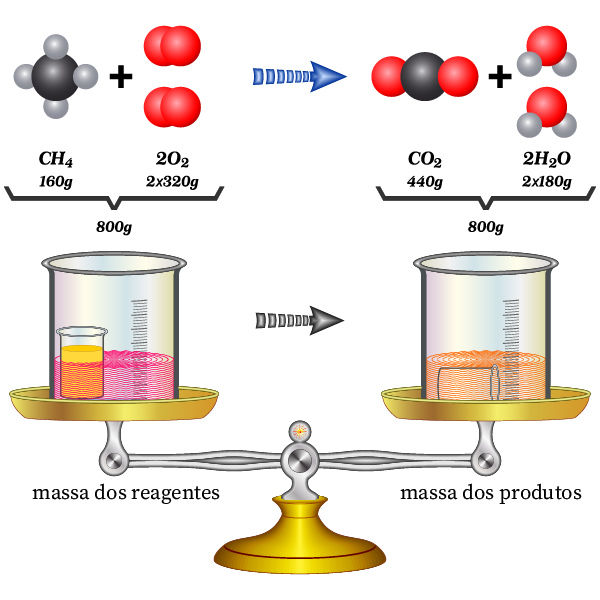
-
Descontinuidade: a matéria é formada por partículas microscópicas, além de espaços vazios. De modo geral, a matéria é formada por moléculas, que são formadas por átomos, que são formados por elétrons, próton e nêutrons, que, por sua vez, são formados por partículas ainda menores.
→ Propriedades específicas da matéria
As propriedades específicas são características únicas de cada substância que permitem identificar e diferenciar uma substância de outra. Essas propriedades, ainda, podem ser divididas em físicas, químicas, organolépticas e funcionais.
-
Propriedades físicas: são observadas sem alterar a composição da substância. Essas propriedades são:
-
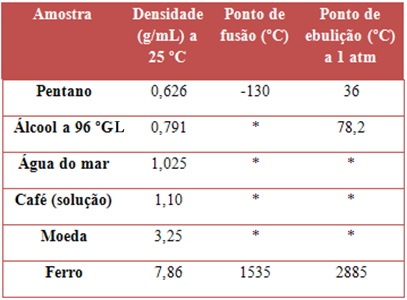
Ponto de fusão (PF): é a temperatura na qual uma substância muda do estado sólido para o estado líquido, mantendo a pressão constante.
-
Ponto de ebulição (PE): é a temperatura na qual uma substância líquida passa para o estado gasoso, quando a pressão de vapor da substância se iguala à pressão externa.
-
Densidade: é uma propriedade física que relaciona a massa de uma substância com o volume que ela ocupa. Em termos simples, a densidade indica o grau de compactação da matéria num determinado espaço. Essa propriedade é fundamental para identificar e diferenciar materiais, além de ser amplamente utilizada em áreas como Química, Física e Engenharia.
-
Solubilidade: é a capacidade de uma substância se dissolver em outra, formando uma solução homogênea. Um exemplo é o sal de cozinha (NaCl), solúvel em água, enquanto o óleo não é.
-
Condutividade elétrica: é a capacidade de uma substância conduzir corrente elétrica. Por exemplo, metais como o cobre são bons condutores de eletricidade, enquanto a borracha é um isolante.
-
Maleabilidade: é a capacidade de um material ser deformado em lâminas finas por meio de martelos ou rolos, sem se romper. Um exemplo é o ouro, um metal altamente maleável que pode ser transformado em folhas muito finas.Ductibilidade: é a capacidade de um material ser deformado em fios finos por meio de tração. Por exemplo, o cobre é um metal dúctil, utilizado na fabricação de fios elétricos.
- Ductibilidade: é a capacidade de um material ser deformado em fios finos por meio de tração. Por exemplo, o cobre é um metal dúctil, utilizado na fabricação de fios elétricos.
-
Magnetismo: é a propriedade de um material atrair ou repelir outros materiais magnéticos. Exemplos muito comuns são os ímãs, que têm propriedades magnéticas e atraem materiais ferrosos, como o ferro.
-
Dureza: é a resistência de um material à penetração ou abrasão. Um exemplo é o diamante, o material natural mais duro conhecido.
-
Viscosidade: é a resistência de um fluido ao escoamento. Por exemplo, a água tem baixa viscosidade, enquanto a mel tem alta viscosidade.
-
- Propriedades química: são características de uma substância que se manifestam durante uma reação química, ou seja, quando a substância se transforma em outra. Essas propriedades envolvem alterações na composição da matéria, resultando em novas substâncias com propriedades diferentes. As propriedades químicas são:
- Combustibilidade: capacidade de uma substância queimar em presença de oxigênio. Um exemplo é a gasolina, amplamente utilizada como combustível.
- Reatividade: facilidade com que uma substância reage com outras. Por exemplo, o sódio reage violentamente com a água.
- Oxidação: tendência de uma substância a perder elétrons. Um exemplo é a formação da ferrugem, resultado da oxidação do ferro.
- Corrosividade: capacidade de uma substância corroer ou desgastar outros materiais. Por exemplo, os ácidos são substâncias corrosivas.
Vale destacar que as propriedades químicas podem variar bastante e são específicas para cada tipo de substância.
- Propriedades organolépticas: são características da matéria percebidas pelos sentidos humanos, como visão, olfato, tato, paladar e audição. Essas propriedades permitem identificar e descrever os materiais com base em aspectos sensoriais, desempenhando um papel crucial em diversos contextos, como a análise de alimentos, medicamentos e produtos industriais. Entre as principais propriedades organolépticas, estão:
- Cor: percebida pela visão, a cor de uma substância é frequentemente utilizada como indicador de sua composição ou pureza. Por exemplo, o ouro puro apresenta coloração amarela característica, enquanto impurezas podem alterar sua tonalidade.
- Odor: o olfato detecta compostos voláteis presentes em uma substância. Aromas agradáveis, como o da baunilha, indicam presença de moléculas específicas (vanilina), enquanto odores desagradáveis podem apontar deterioração, como no caso de alimentos em decomposição.
- Textura (rugosidade e rigidez): sentida pelo tato, a textura indica como a superfície de uma substância interage com o toque. Materiais como o vidro são rígidos e lisos, enquanto tecidos podem ser macios e rugosos.
- Som: a audição também desempenha um papel na percepção de materiais. Por exemplo, o som produzido ao bater em um vidro ou em um metal pode indicar diferenças na densidade ou integridade do material.
- Sabor: é uma característica que pode ser percebida pelos nossos paladares. Ele é o resultado da combinação de diversas sensações, como o gosto (doce, amargo, azedo, salgado e umami).
- Propriedades funcionais: são aquelas que descrevem o comportamento químico específico de uma substância, determinando sua função química. Essas funções são definidas com base nas características e reações típicas de certos grupos de substâncias. No estudo da Química, as principais funções químicas incluem ácidos, bases, sais e óxidos.
- Ácidos: substâncias que têm um sabor azedo característico e podem reagir com metais e bases para formar sais. Um exemplo de ácido é o ácido acético, encontrado no vinagre. Outra característica é que, em solução aquosa, os ácidos podem alterar a cor de indicadores, como o tornassol, que fica vermelho na presença de ácidos.
- Bases: são substâncias que têm sabor adstringente e sensação escorregadia ao toque. As bases reagem com ácidos, neutralizando-os, e são utilizadas em diversos processos industriais e no cotidiano, como o hidróxido de sódio, presente em limpadores.
- Sal: resulta da reação entre ácidos e bases, sendo substâncias amplamente utilizadas em diferentes contextos. Por exemplo, o cloreto de sódio, conhecido como sal de cozinha, é essencial na alimentação humana. Sais podem apresentar diferentes sabores, como salgado ou amargo, dependendo da substância.
- Óxidos: são compostos formados pela combinação de um elemento químico com o oxigênio. Alguns óxidos, como o dióxido de carbono, estão presentes no ar e têm papel fundamental em processos naturais, como a fotossíntese.
Leia também: Como ocorrem as mudanças de estado físico da matéria
Importância das propriedades da matéria
O conhecimento das propriedades da matéria é essencial para entender como os materiais se comportam e interagem em diferentes condições. Essas propriedades permitem a identificação de substâncias, a previsão de seu comportamento e a aplicação prática em diversas áreas, como Química, Física, Biologia e Engenharia.
No cotidiano, compreender as propriedades da matéria é fundamental para selecionar materiais adequados para diferentes usos. Por exemplo, a densidade de uma substância pode determinar sua capacidade de flutuar ou afundar em um líquido, enquanto a resistência térmica é importante na escolha de utensílios para cozinhar.
Na indústria, o estudo das propriedades da matéria é essencial para desenvolver novos produtos e melhorar processos. A maleabilidade e a dureza de metais, por exemplo, são propriedades avaliadas na fabricação de estruturas e equipamentos. Da mesma forma, as propriedades químicas de substâncias permitem a criação de medicamentos, combustíveis e materiais inovadores.
Além disso, a análise das propriedades da matéria tem impacto direto na ciência e tecnologia. Descobrir como os materiais respondem a variações de pressão, temperatura e outras condições ajuda a desenvolver soluções para problemas globais, como o armazenamento de energia e a proteção ambiental.
Assim, o conhecimento das propriedades da matéria não apenas facilita a compreensão dos fenômenos naturais como também contribui para o avanço tecnológico e a melhoria da qualidade de vida, mostrando-se indispensável para o desenvolvimento da ciência e da sociedade.
Experiências sobre propriedades da matéria
As diferentes propriedades da matéria podem ser verificadas por meio de experimentos simples e seguros, como os que são descritos a seguir
|
Experimento 1: Verificando a densidade com água e óleo Objetivo: Demonstrar a diferença de densidade entre substâncias. Materiais:
Procedimento:
Mudança observada: A água permanece no fundo do copo, enquanto o óleo flutua, demonstrando que o óleo tem menor densidade. |
|
Experimento 2: Quebrando palitos de madeira Objetivo: Demonstrar uma transformação física ao aplicar força. Materiais:
Procedimento:
Mudança observada: O palito de madeira sofre uma transformação física, sendo dividido em pedaços menores, sem alterar sua composição química. |
|
Experimento 3: Determinando a massa de objetos Objetivo: Demonstrar a propriedade da massa. Materiais:
Procedimento:
Mudança observada: Não há alteração na matéria dos objetos, mas observa-se a propriedade geral da massa, uma característica inerente de qualquer corpo material. |
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond. Química Geral: Conceitos Essenciais. 4ªed. São Paulo: McGraw-Hill, 2007.