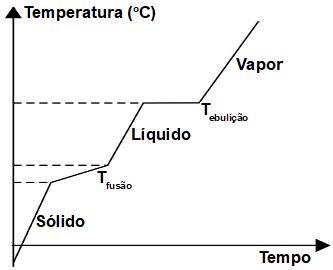
As misturas azeotrópicas se caracterizam pelo comportamento diferenciado quando submetidas à ebulição. Tomemos por exemplo a água (substância pura). A temperatura de ebulição (TE) da H2O é 100 °C, mas o que acontece se acrescentramos a ela outra substância, como por exemplo, o açúcar? Teremos uma mistura homogênea cujo ponto de ebulição não será constante, tudo porque a TE desses dois componentes se diferem. A água pura tem sua TE menor que a mistura.
Em se tratando da mistura azeotrópica, esta se comporta como se fosse substância pura em relação à ebulição, apesar de ter em sua composição duas substâncias diferentes. A temperatura mantém-se inalterada do início ao fim da ebulição (PE constante).
Exemplos:
acetona (86,5%) + metanol (13,5%)
álcool etílico (7%) + clorofórmio (93%)
ácido fórmico (77,5%) + água (22,5%)
Uma mistura azeotrópica muito conhecida é o álcool etílico, ele é composto de 95,5% de álcool e 4,5% de água (TE = 78,1° C). Esta mistura homogênea de líquidos não pode ter seus componentes separados por métodos convencionais como a destilação. Isto só seria possível se os pontos de ebulição fossem diferentes, o que não acontece com misturas azeotrópicas.
No processo de obtenção do álcool anidro é preciso recorrer a métodos especiais de separação de misturas. Este álcool, também conhecido como álcool absoluto, precisa apresentar no máximo 1 % de água, é o que se conhece por álcool puro.
Método de obtenção do álcool anidro: Adiciona-se o composto óxido de cálcio (CaO) ao álcool comum (etanol) e só então a mistura é destilada. Durante o processo, o CaO
forma com a água um precipitado - Ca(OH)2 – sendo possível retirá-lo do processo. O álcool é então extraído de forma pura.
O álcool anidro precisa apresentar no mínimo 99,5 % de pureza, é usado na obtenção de medicamentos.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola