O cloreto de vinila é um hidrocarboneto clorado tóxico e com ação carcinogênica. É um gás incolor em temperatura ambiente, sendo altamente inflamável e sensível ao calor.
Trata-se do monômero empregado na fabricação do policloreto de vinila, substância conhecida como PVC. O PVC é um termoplástico resistente ao calor (ao contrário de seu monômero) que possui inúmeras aplicações no cotidiano, como revestimentos de fios elétricos, construção de tubulações e de diversos tipos de embalagens.
Leia também: Amianto — fibra natural com larga aplicação industrial, mas extremamente tóxica ao ser humano
Tópicos deste artigo
- 1 - Resumo sobre o cloreto de vinila
- 2 - Propriedades cloreto de vinila
- 3 - O que é cloreto de vinila?
- 4 - Características do cloreto de vinila
- 5 - Para que serve o cloreto de vinila?
- 6 - Obtenção do cloreto de vinila
- 7 - Precauções com o cloreto de vinila
- 8 - Ocorrência do cloreto de vinila
- 9 - História do cloreto de vinila
Resumo sobre o cloreto de vinila
-
O cloreto de vinila é um hidrocarboneto clorado com fórmula H2C=CHCl.
-
É um gás incolor, de odor adocicado e altamente inflamável.
-
O cloreto de vinila é instável ao calor, sofrendo decomposição.
-
A principal aplicação do cloreto de vinila é na fabricação do policloreto de vinila (PVC).
-
O PVC é um termoplástico com inúmeras aplicações, como tubulações, peças, revestimentos, embalagens etc.
-
O cloreto de vinila é tóxico e tem efeito carcinogênico.
Propriedades cloreto de vinila
-
Fórmula molecular: CH2CHCl (C2H3Cl).
-
Massa molecular: 62,498 g/mol.
-
Estado físico: gás (incolor e de forte odor).
-
Densidade: 0,91 g/mL.
-
Solubilidade em água: muito pouco solúvel (0,6g em 100 mL de água, 20 °C).
-
Temperatura de fusão: -154 °C.
-
Temperatura de ebulição: -13 °C.
O que é cloreto de vinila?
O cloreto de vinila é um hidrocarboneto clorado com fórmula H2C=CHCl. Em temperatura ambiente, ocorre com um gás incolor e altamente inflamável.
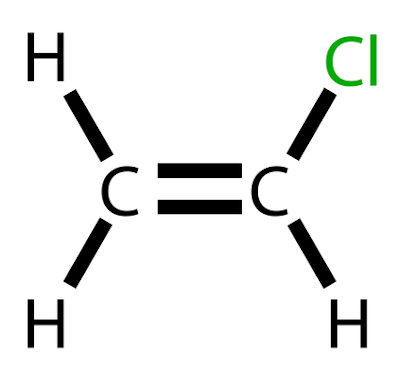
O cloreto de vinila, também denominado cloroeteno ou monômero de cloreto de vinila, é um produto químico de grande importância na indústria, tendo especial aplicação na fabricação do polímero policloreto de vinila, mais conhecido como PVC. Esse composto ocupa a lista dos 20 produtos derivados do petróleo de maior relevância industrial e econômica.
Leia também: Benzopireno — hidrocarboneto cancerígeno encontrado na fumaça de cigarro e em carnes grelhadas
Características do cloreto de vinila
O cloreto de vinila é um gás incolor com odor suave e adocicado. Possui a propriedade de ser altamente inflamável.
Quando exposto a fontes de calor, pode sofrer decomposição, emitindo vapores tóxicos de dióxido de carbono, monóxido de carbono, cloreto de hidrogênio e fosgênio. Por ser um composto orgânico, sua solubilidade em água é extremamente baixa, por outro lado é solúvel em substâncias como o etanol, benzeno e tetracloreto de carbono.
Na presença de umidade, o cloreto de vinila se torna corrosivo, podendo atacar o ferro e o aço. Possui capacidade de polimerização quando exposto ao calor em ar atmosférico, mediante uma reação exotérmica. Dessa propriedade derivam muitas das suas aplicações industriais.
O cloreto de vinila demanda atenção, pois apresenta toxicidade e é carcinogênico.
Para que serve o cloreto de vinila?
O cloreto de vinila é o monômero empregado para a fabricação do polímero PVC (policloreto de vinila) e de outros solventes clorados.
O PVC é um termoplástico usado na manufatura de embalagens, calçados, conexões e cabos elétricos, tubulações, janelas, tubos e bolsas de coleta de sangue, peças de vestuário, entre inúmeros outros itens.

O PVC é formado pela polimerização do cloreto de vinila. Nesse processo químico, uma grande quantidade de moléculas de cloreto de vinila se adicionam umas às outras, formando uma grande estrutura química.
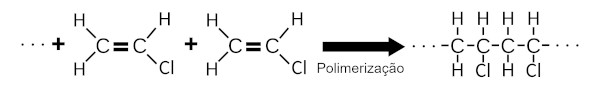
O PVC é resistente à propagação de chamas e por isso é muito empregado no revestimento de fios, de cabos elétricos e em revestimentos residenciais.
Apesar de o cloreto de vinila ser um composto químico que demanda atenção em razão de sua toxicidade e instabilidade térmica, o seu polímero PVC é bastante estável a fontes de calor, não é tóxico e pode ser armazenado com segurança.
Até o ano de 1974, o cloreto de vinila era empregado em aerossóis. No passado, foi utilizado até mesmo como anestésico inalatório. Com o conhecimento da toxicidade desse composto, essas aplicações foram descontinuadas.
Obtenção do cloreto de vinila
A síntese do cloreto de vinila empregada em escala industrial é iniciada com o composto etileno ou eteno (CH2=CH2) e pode ocorrer por duas rotas.
Na primeira delas, o etileno é convertido em 1,2-dicloroetano por meio da reação com o gás cloro. Em seguida, pelo aquecimento do 1,2-dicloroetano na presença de catalisador, obtém-se o cloreto de vinila como produto principal e o ácido clorídrico como produto secundário.
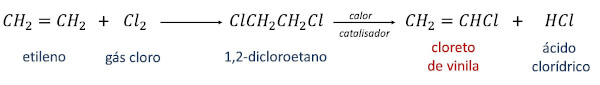
Na segunda rota de reação, conhecida como oxicloração, ocorre a reação entre o etileno, o ácido clorídrico e o oxigênio da própria atmosfera, na presença de calor e de catalisador, gerando como produtos o cloreto de vinila e água.

Geralmente, um centro de fabricação de cloreto de vinila é construído para contemplar os dois processos de fabricação citados, de maneira que o ácido clorídrico gerado no primeiro método atue como reagente para a realização da segunda rota.
Precauções com o cloreto de vinila
O cloreto de vinila é um composto tóxico. Por ser um gás, a principal forma de contaminação é por inalação, por isso sua manipulação deve ser feita sempre com a utilização de equipamentos adequados, como as máscaras de gás.
A exposição a essa substância afeta o sistema nervoso periférico e central, ocasionado danos ao fígado. A exposição contínua pode desencadear o fenômeno de Raynaud, que é um conjunto de sintomas que incluem dores articulares e musculares e alterações cutâneas, que podem evoluir para a perda completa da elasticidade da pele, afetando inclusive órgãos internos e vasos sanguíneos.
Outros efeitos incluem euforia, desorientação, aborto espontâneo e defeitos congênitos. Lesões no tecido ocular também são registrados.
Os sintomas dependem do nível de exposição à substância, variando desde tonturas, náuseas, distúrbios visuais, cefaleia e ataxia na exposição aguda (de 1000 a 8000 ppm de cloreto de vinila no ar), até efeito narcótico, arritmia cardíaca e insuficiência respiratória fatal nos casos de exposição a níveis acima de 12000 ppm.
-
Cloreto de vinila e o câncer
O cloreto de vinila é uma substância carcinogênica, associada a um elevado risco de desenvolvimento de câncer de fígado, podendo contribuir para ocorrências de câncer de cérebro e de pulmão, bem como de câncer do sistema linfático.
Leia também: Nitrato de amônio — composto aplicado na agricultura que pode causar explosões
Ocorrência do cloreto de vinila
O cloreto de vinila é gerado espontaneamente no ambiente por meio da decomposição de alguns compostos contendo cloro, mediante a ação de microrganismos. Por isso, pode ser considerado um contaminante de ar e de água, especialmente em regiões próximas a aterros sanitários.
No entanto, a maior ocorrência do cloreto de vinila é por rotas sintéticas, relacionadas à indústria química, como abordado anteriormente.
História do cloreto de vinila
O cloreto de vinila foi descoberto em 1835 pelo químico alemão Justus von Liebig, ao reagir dicloetano com hidróxido de potássio em ambiente alcoólico.
Mais tarde, em 1872, o químico Eugen Baumann observou pela primeira vez a polimerização do cloreto de vinila, originando o PVC, após deixar um recipiente com a substância exposto ao Sol por acidente.
Em 1926, o inventor americano Waldo Semon descobriu aditivos químicos que forneceram maior elasticidade e maleabilidade ao PVC, expandindo as possibilidades de aplicação dessa substância. Em torno de 1950, o PVC passou a ser empregado em escala industrial. Atualmente, o PVC é um dos termoplásticos mais utilizados no mundo.
Por Ana Luiza Lorenzen Lima
Professora de Química
