Os átomos de Carbono podem se unir de várias formas diferentes, formando inúmeras substâncias, a esta propriedade denominamos de Alotropia.
O diamante, o grafite e o fulereno são alótropos do carbono e se diferem pelo arranjo geométrico. Estas três formas são substâncias simples formadas apenas por carbono, porém, a grande diferença entre elas é a maneira como os átomos ficam organizados nas moléculas, ou seja, o rearranjo dos átomos.
Propriedades químicas dos alótropos do carbono:
O grafite, presente na ponta do lápis, é a forma mais estável do carbono, constitui um sólido macio e cinza, é um bom condutor de calor e eletricidade e possui densidade = 2,25 g/cm3.
O diamante, por sua vez, é um isolante elétrico e térmico, transparente e duro. Por esta última característica é utilizado para cortar blocos de granito. Sua densidade é 3,51g/cm3.
O fulereno, devido à sua forma tridimensional com ligações insaturadas, apresenta propriedades físicas e químicas únicas que podem ser exploradas em várias áreas da bioquímica e da medicina.
Observe a diferença no rearranjo molecular dos alótropos do carbono:
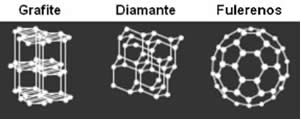
Repare que as três formas são compostas pelo mesmo elemento (carbono), mas que devido ao rearranjo dos átomos se transformam em substâncias com propriedades completamente diferentes.
Obtenção das formas alotrópicas do carbono:
Se aquecermos um diamante até 1800 °C na presença de oxigênio, ele se transforma lentamente em grafite. Mas se for feito o contrário, aplicando-se enorme pressão sobre pequenas quantidades de grafite, surge o diamante (a natureza é responsável por este processo).
Já os fulerenos surgiram mais tarde e foram a novidade científica em meados da década de 1980. Este alótropo do carbono foi sintetizado pela primeira vez em 1985 através da evaporação do grafite com raios laser.
Por Líria Alves
Graduada em Química
