Forças intermoleculares são forças de natureza elétrica existentes nas interações intermoleculares. Tais interações são responsáveis por propriedades físicas das substâncias, como o ponto de ebulição, e são mais fracas que as forças intramoleculares, também conhecidas como ligações químicas.
As forças intermoleculares dependem da polaridade da molécula. As moléculas polares apresentam interações mais fortes que as moléculas apolares, por conta da formação de cargas formais de natureza positiva e negativa. As moléculas também podem interagir com íons e podem ser dispostas em intensidades diferentes.
Leia também: Forças intermoleculares no Enem — o que estudar?
Tópicos deste artigo
- 1 - Resumo sobre forças intermoleculares
- 2 - Forças intermoleculares e interações intermoleculares
- 3 - Quais são os tipos de interações intermoleculares
- 4 - Diferenças entre forças intermoleculares e forças intramoleculares
- 5 - Forças intermoleculares e ponto de ebulição
- 6 - Exercícios resolvidos sobre forças intermoleculares
Resumo sobre forças intermoleculares
- As forças intermoleculares são forças de natureza elétrica que surgem por meio da interação entre moléculas.
- São mais fracas que as forças intramoleculares, existentes nos processos de ligação química.
- Os processos de interação intermolecular influenciam diretamente nas propriedades físicas das substâncias.
- O tipo de interação intermolecular que a molécula realiza depende do seu caráter polar ou ausência dele.
- Moléculas podem também interagir com íons.
Forças intermoleculares e interações intermoleculares
Quando átomos, moléculas ou íons se aproximam, há duas possibilidades: reação ou interação. Um processo de reação envolve quebra e formação de ligações químicas, o que requer muito mais energia. Na interação, as moléculas se atraem e se repelem, mas sem ocorrência de formação ou ruptura de novas ligações químicas. Tais interações são bem menos energéticas e são comumente chamadas de interações intermoleculares.
As interações intermoleculares são consequência da ação das forças intermoleculares, as quais são de natureza elétrica e demonstram como uma molécula pode influenciar no comportamento da outra. As forças intermoleculares são inversamente proporcionais à distância entre as moléculas, ou seja, quanto mais próximas estão as moléculas, mais intensas são as forças intermoleculares.
Quais são os tipos de interações intermoleculares
-> Interações iônicas
São interações eletrostáticas fortes que ocorrem entre um cátion e um ânion. Esse tipo de interação é predominante em compostos iônicos, como em sais inorgânicos (como NaCl) e orgânicos (como no CH3COONa, acetato de sódio). Matematicamente, essa interação pode ser descrita pela lei de Coulomb:
\(F=k\frac{q_1q_2}{\varepsilon r^2}\)
Em que q1 e q2 são as cargas do ânion e do cátion, r é a distância que os separa e ε é a constante dielétrica (ou permissividade relativa), e, na prática, a constante dielétrica mensura o quanto uma carga blinda a outra a depender do meio. Em água, a constante dielétrica é igual a 80, no vácuo, é igual a 1.
Salienta-se, entretanto, que compostos iônicos não são moleculares, ou seja, a interação entre íons não forma moléculas.
-> Interação dipolo-dipolo
Essa modalidade de interação ocorre entre moléculas polares. Tais moléculas apresentam, por consequência das diferenças de eletronegatividades dos átomos presentes, um dipolo elétrico permanente, com uma de carga parcial positiva (δ+) e uma carga parcial negativa (δ–).
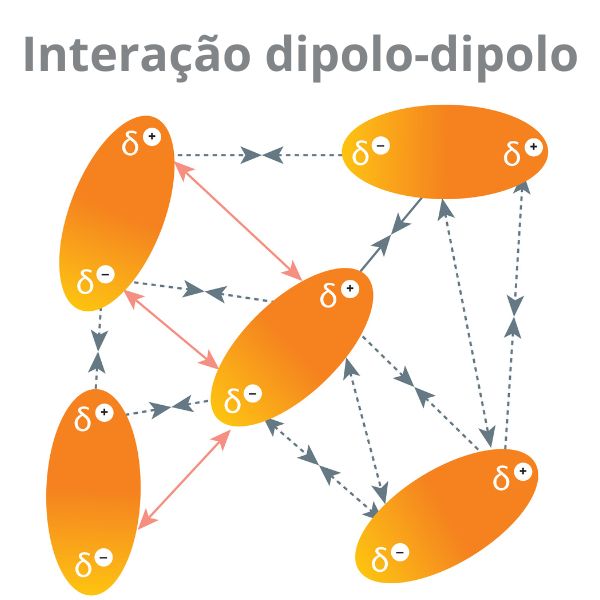
A interação dipolo-dipolo ocorre quando tais dipolos se orientam, podendo gerar forças atrativas ou repulsivas, a depender da natureza de sua carga parcial.
-> Ligação de hidrogênio
Quando o hidrogênio está ligado a um átomo muito eletronegativo (átomo doador), eles podem fazer ligações mais fracas com um par isolado de elétrons de outro átomo muito eletronegativo (átomo aceptor). Em geral, tais átomos eletronegativos são flúor (F), oxigênio (O) e nitrogênio (N).
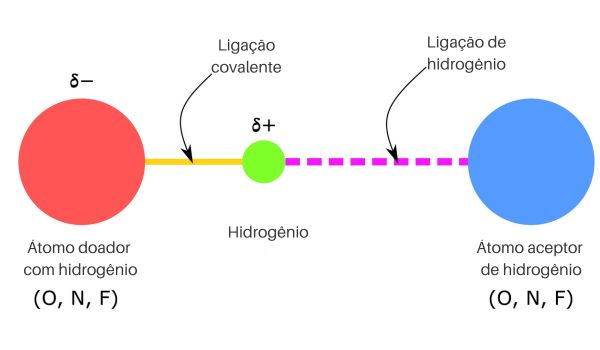
Nessas condições, o hidrogênio fica com uma carga parcial muito positiva, dada a grande diferença de eletronegatividade. Além disso, como os átomos envolvidos são muito pequenos, a distância dessa interação é muito pequena, resultando em uma interação muito forte.
-> Interações íon-dipolo
Um dipolo, apresentando uma carga formal positiva e uma carga formal negativa, pode interagir com cátions e ânions. Essa interação é muito comum em soluções, quando compostos iônicos se dissolvem em solventes polares. No caso, os íons são envoltos em solução pelas moléculas do solvente polar.
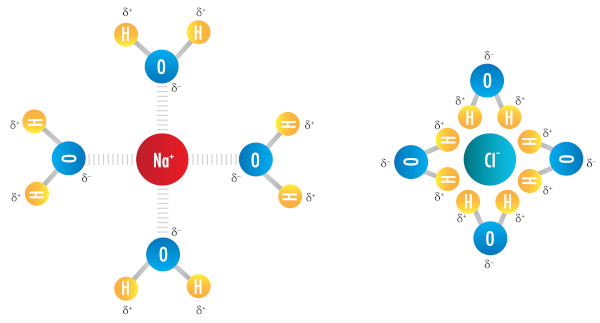
-> Interações dipolo-dipolo induzido
Uma molécula pode, por conta de seu arranjo tridimensional, não apresentar dipolo elétrico, mesmo havendo ligações polares em sua estrutura. Isso porque os dipolos são propriedades vetoriais, e, por conta da geometria da molécula, tais vetores podem se anular ao se somarem, gerando uma resultante nula.
Quando isso ocorre, estamos diante de uma molécula apolar. Mesmo assim, uma molécula polar pode induzir um dipolo elétrico em uma molécula apolar.
Tal interação é conhecida como dipolo-dipolo induzido e depende de dois fatores:
- da magnitude do dipolo da molécula polar;
- da polarizabilidade da molécula apolar.
A polarizabilidade é a facilidade de distorção da nuvem eletrônica de uma molécula por um campo elétrico (como quando a molécula polar se aproxima). Se a molécula sofre uma distorção em sua nuvem eletrônica, os seus elétrons deixam de ter uma distribuição homogênea e, por conseguinte, cria-se um dipolo elétrico instantâneo. É esse dipolo instantâneo que pode interagir com o dipolo permanente.
-> Interações dipolo induzido-dipolo induzido
Quando duas moléculas apolares se encontram, pode ocorrer a perturbação de suas densidades eletrônicas, algo intimamente ligado à polarizabilidade. Nessa perturbação, dipolos momentâneos podem surgir, orientando-se e dando origem a uma interação muito fraca, conhecida como dipolo induzido-dipolo induzido (ou, ainda, como forças de London ou forças de van der Waals).
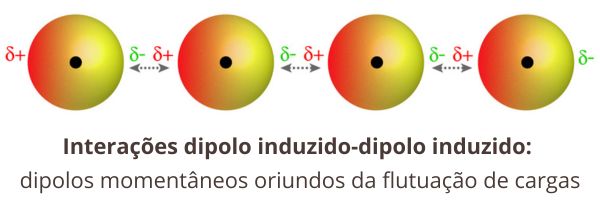
É uma interação que está presente em todas as moléculas, mas só se torna aparente quando as demais não estão (ou seja, em moléculas apolares). Apesar de ser fraca, possui um efeito cumulativo: quanto maior a molécula, mais intensa ela é.
-> Videoaula sobre tipos de forças intermoleculares
Diferenças entre forças intermoleculares e forças intramoleculares
As forças intramoleculares são aquelas que, como o próprio nome diz, ocorrem no interior da molécula, mantendo os átomos unidos. São responsáveis pelas propriedades químicas dos compostos e são comumente conhecidas como ligações químicas, sendo divididas em: iônica, covalente ou metálica. Já as forças intermoleculares são responsáveis pelas interações entre as moléculas e ainda pelas propriedades físicas dos compostos.
As ligações químicas ou forças intramoleculares são processos de maior energia, variando entre 50 kcal.mol-1e 100 kcal.mol-1, enquanto as forças intermoleculares são mais fracas, envolvendo energias na faixa de 0,5 kcal.mol-1 a 10 kcal.mol-1.
Do ponto de vista energético e pelo fato de íons não serem compostos covalentes, as interações iônicas, para alguns autores, não são tratadas como interações intermoleculares, mas como processos de ligação química. Contudo, a interação iônica explica boa parte das propriedades físicas dos compostos iônicos, e, nesse quesito, convém trazer sua discussão dentro do tópico de forças intermoleculares.
Saiba mais: Como descobrir a camada de valência de um átomo?
Forças intermoleculares e ponto de ebulição
Como pontuado, as forças intermoleculares são responsáveis pelas propriedades físicas da substância. Isso quer dizer que elas também influenciam nas mudanças de estado físico das substâncias químicas como um todo. Por exemplo, se uma força intermolecular é mais intensa, espera-se que o afastamento entre as moléculas seja mais difícil e, consequentemente, que o ponto de ebulição para essa substância seja maior.
Podemos colocar as forças intermoleculares na seguinte ordem crescente de intensidade:
Dipolo induzido-dipolo induzido < dipolo-dipolo induzido < dipolo-dipolo < ligação de hidrogênio < íon-dipolo < interações iônicas
A intensidade da força intermolecular também aumenta com o volume da molécula. No caso de moléculas polares, um maior volume molecular permite um melhor estabelecimento das cargas formais e um maior distanciamento entre cargas formais de mesmo sinal de moléculas diferentes (minimizando efeitos repulsivos).
Já no caso de moléculas apolares, o maior volume molecular favorece a polarizabilidade, favorecendo a distorção da nuvem eletrônica e auxiliando no processo de polarização momentânea.
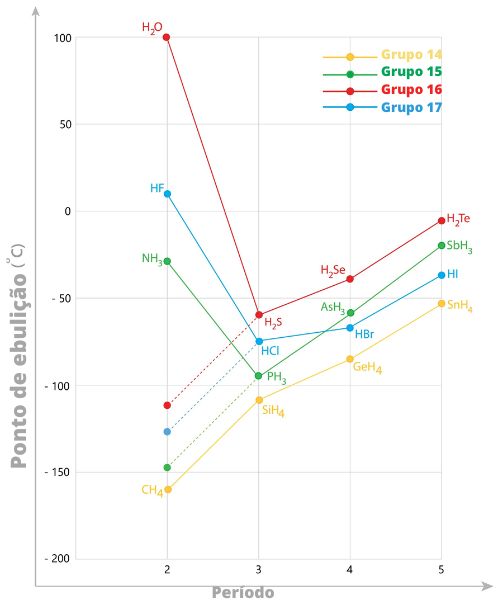
Na imagem anterior, perceba os hidretos do grupo 14 (CH4, SiH4, GeH4 e SnH4), em amarelo. Todos são apolares e realizam interação do tipo dipolo induzido-dipolo induzido. Conforme o raio aumenta (com o aumento do período), a temperatura de ebulição aumenta, o que é esperado pelo aumento da polarizabilidade.
Para os 15 (verde), 16 (vermelho) e 17 (azul), esperava-se comportamento semelhante, com a diferença de que, como todos os compostos são polares, as interações são do tipo dipolo-dipolo. Ocorre que H2O, HF e NH3 são capazes de interagir por ligações de hidrogênio, muito mais intensas, e, por isso, apresentam um desvio em relação ao esperado (compare com a linha tracejada), com um ponto de ebulição muito maior.
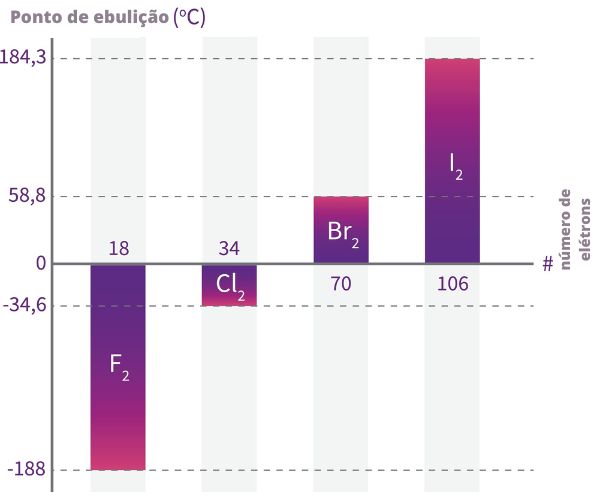
As substâncias simples dos elementos do grupo 17 da Tabela Periódica também apresentam um comportamento interessante.
|
Substância |
Tipo de interação |
Estado físico em condições ambiente |
|
F2 |
Dipolo induzido-dipolo induzido |
Gás |
|
Cl2 |
Gás |
|
|
Br2 |
Líquido |
|
|
I2 |
Sólido |
Apesar de todas as substâncias terem a mesma interação (afinal, são todos compostos apolares), percebe-se que o ponto de ebulição aumenta com o aumento do raio. Isso é consequência direta do efeito da polarizabilidade. O I2, uma molécula maior, é muito mais polarizável que o F2, uma molécula menor. Vale lembrar que as interações do tipo dipolo induzido-dipolo induzido são também cumulativas.
Exercícios resolvidos sobre forças intermoleculares
Questão 1. (Enem)
O carvão ativado é um material que possui elevado teor de carbono, sendo muito utilizado para a remoção de compostos orgânicos voláteis do meio, como o benzeno. Para a remoção desses compostos, utiliza-se a adsorção. Esse fenômeno ocorre por meio de interações do tipo intermoleculares entre a superfície do carvão (adsorvente) e o benzeno (adsorvato, substância adsorvida).
No caso apresentado, entre o adsorvente e a substância adsorvida, ocorre a formação de:
a) ligações dissulfeto
b) ligações covalentes
c) ligações de hidrogênio
d) interações dipolo induzido-dipolo induzido
e) interações dipolo permanente-dipolo permanente
Resposta:
Letra D
O benzeno é um hidrocarboneto, e tal classe de compostos é considerada apolar ou muito pouco polar. O carvão ativado é uma substância em que se predomina os átomos de carbono e também o caráter apolar.
Dessa forma, como se trata de dois compostos majoritariamente apolares, é possível afirmar que a interação entre ambos será do tipo dipolo induzido-dipolo induzido.
Questão 2. (Enem)
Partículas microscópicas existentes na atmosfera funcionam como núcleos de condensação de vapor de água que, sob condições adequadas de temperatura e pressão, propiciam a formação das nuvens e consequentemente das chuvas. No ar atmosférico, tais partículas são formadas pela reação de ácidos (HX) com a base NH3, de forma natural ou antropogênica, dando origem a sais de amônio (NH4X), de acordo com a equação química genérica:
HX (g) + NH3 (g) NH4X (s)
FELIX. E. P.; CARDOSO, A. A. Fatores ambientais que afetam a precipitação úmida. Química Nova na Escola, n. 21, maio 2005 (adaptado).
A fixação de moléculas de vapor de água pelos núcleos de condensação ocorre por
a) ligações iônicas.
b) interações dipolo-dipolo.
c) interações dipolo-dipolo induzido.
d) interações íon-dipolo.
e) ligações covalentes.
Resposta:
Letra D
O NH4X, como um sal, ao entrar em contato com a umidade, sofre dissociação iônica:
NH4X (s) → NH4+ (aq) + X– (aq)
Tais espécies iônicas, em contato com a água (um solvente polar), interagirão por meio de interações do tipo íon-dipolo.
Por Stéfano Araújo Novais
Professor de Química

