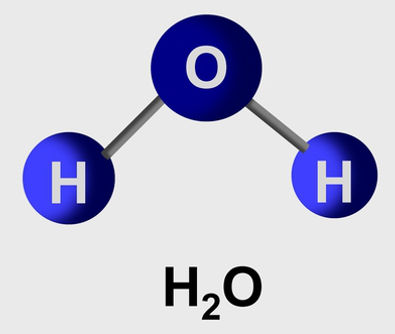
Uma molécula é um grupo de átomos de um mesmo elemento ou de elementos diferentes. Veja alguns exemplos:
-
H2O – molécula formada por dois elementos diferentes (dois átomos de Hidrogênio e um átomo de Oxigênio);
-
Cl2 – molécula formada por apenas um único elemento químico (dois átomos de Cloro).
As moléculas podem ser classificadas em polares ou apolares:
-
apolares: moléculas que não apresentam polos (positivo e negativo);
-
polares: moléculas que apresentam polos (positivo e negativo).
Neste texto, vamos dar ênfase nas moléculas polares. Para identificar uma molécula polar, podemos utilizar uma das estratégias propostas a seguir:
a) Composto iônico (formado por ligação iônica)
Se a substância é originada por ligação iônica (entre um metal e um ametal), quer dizer que ela é formada por íons (cátion e ânion). Assim sendo, essa substância automaticamente apresenta moléculas polares, já que os íons possuem cargas positivas e negativas.
Exemplos:
-
NaCl (Na é um metal, e o Cl é um ametal);
-
CaO (Ca é um metal, e O é um ametal);
-
MgS (Mg é um metal, e S é um ametal).
b) Compostos moleculares (formados por ligação covalente)
Quando o composto é molecular, devemos analisar cada caso, já que temos a possibilidade de várias moléculas diferentes. A seguir temos alguns exemplos e regras que podem auxiliar na determinação de compostos moleculares polares:
- Molécula diatômica com elementos diferentes
Se o composto molecular for formado por dois átomos apenas e esses dois átomos forem de elementos diferentes, automaticamente a molécula será polar pelo fato de os dois átomos apresentarem diferentes eletronegatividades. Exemplos: HBr e NO.
- Moléculas com dois ou mais átomos (iguais ou diferentes)
Em moléculas que apresentem um número de átomos maior que dois, devemos levar em consideração a quantidade de nuvens ligantes e não ligantes presentes no átomo central da molécula e compará-la com o número de átomos iguais ligados ao átomo central. As nuvens ligantes são as ligações simples (um elétron da camada de valência de cada átomo envolvido), duplas (dois elétrons da camada de valência de cada átomo envolvido) ou triplas (três elétrons da camada de valência de cada átomo envolvido). Já as nuvens não ligantes são os pares de elétrons da camada de valência que não estão participando das ligações.
Observação: Para saber o número de elétrons na camada de valência de um determinado átomo, basta conhecer sua família periódica:
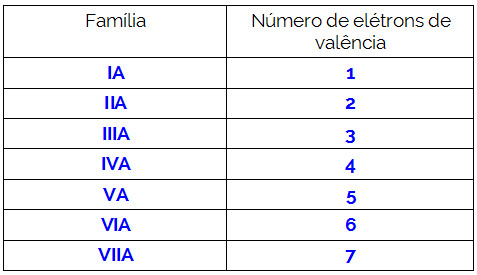
Para determinar se a molécula é polar, basta verificar se o número de nuvens existentes no átomo central é diferente do número de átomos iguais ligados a ele. Veja alguns exemplos:
-
HCN
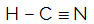
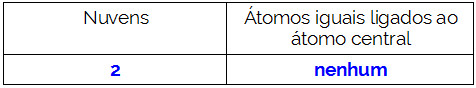
O átomo central da molécula é o carbono e apresenta dois ligantes diferentes, duas nuvens ligantes (simples e tripla) e nenhum par de elétrons não ligantes (é da Família VIA, possui quatro elétrons na camada de valência e está utilizando os quatro, sendo um na ligação simples e três na tripla). Por essa razão, ele forma uma molécula polar.
Resumindo:
-
NH3
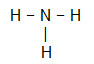
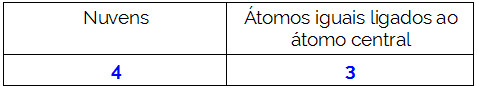
O átomo central da molécula é o nitrogênio e apresenta três ligantes iguais e um total de quatro nuvens, sendo três nuvens ligantes (três ligações simples) e uma não ligante (é da Família VA, possui cinco elétrons na camada de valência e está utilizando apenas três, sendo um em cada ligação simples, sobrando dois não ligantes).
Por conta disso, o átomo central do NH3 forma uma molécula polar.
Resumindo:
-
CH2O
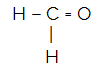
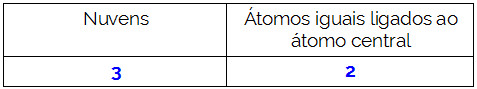
O átomo central da molécula é o carbono e apresenta dois ligantes iguais e um diferente, bem como três nuvens ligantes (duas ligações simples e uma dupla), nenhum par de elétrons não ligantes (é da Família VIA, possui quatro elétrons na camada de valência e está utilizando os 4, sendo dois nas simples e dois na dupla). Por conta disso, ele forma uma molécula polar.
Resumindo:
Por Me. Diogo Lopes Dias