As forças intermoleculares são forças de atração eletrostática que têm por função realizar a união de moléculas (compostos moleculares), mantendo-as no estado sólido ou líquido. Elas são extremamente importantes, haja vista que determinam todas as propriedades físicas (ponto de fusão, ponto de ebulição, densidade e solubilidade) das substâncias.
Neste texto vamos estudar a relação entre as forças intermoleculares e o ponto de ebulição das substâncias. Inicialmente vamos relembrar três importantes tipos de forças intermoleculares, que são:
♦ Dipolo-dipolo: é a força que ocorre em moléculas polares. Como essas moléculas apresentam polo positivo e negativo, a força dipolo-dipolo baseia-se na atração entre a extremidade positiva de uma molécula e a extremidade negativa de outra. Exemplos: HCl, HBr, SO2 e PH3
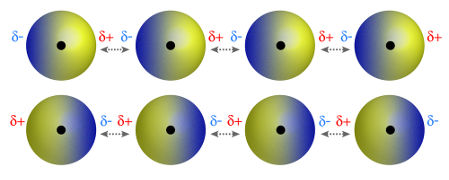
Moléculas que possuem polo positivo e negativo atraindo-se
♦ Dipolo induzido: é a força intermolecular que ocorre apenas em moléculas apolares (não possuem polos). Quando duas moléculas apolares aproximam-se, ocorre uma deformação momentânea de suas nuvens eletrônicas, o que provoca um desequilíbrio nos elétrons da molécula, que se distribuem de forma diferente por ela. Nesse momento, um dipolo momentâneo é criado, e a molécula passa a ter momentaneamente polo positivo e negativo, o que ocasiona a atração. Exemplos: CO2, CH4 e BH3
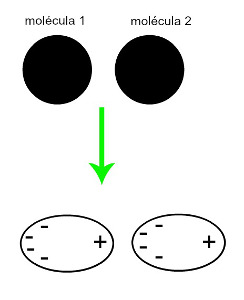
A aproximação de duas moléculas apolares gera uma deformação e, consequentemente, uma redistribuição de elétrons, o que forma os dipolos momentâneos
♦ Ligações de Hidrogênio: é a força intermolecular que ocorre em moléculas polares, porém apenas naquelas que apresentem obrigatoriamente átomos de hidrogênio ligados diretamente com átomos de flúor, oxigênio ou nitrogênio. Pode ser considerada uma força dipolo-dipolo, mas de muito maior intensidade. A interação sempre ocorre entre o hidrogênio de uma molécula e o átomo diferente (F, O, N) de outra molécula. Exemplos: H2O, NH3 e HF
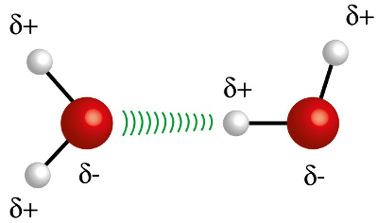
O átomo de hidrogênio (esfera branca) de uma molécula interage com o oxigênio (esfera vermelha) de outra molécula de água
Relembradas as três forças intermoleculares, podemos agora relacioná-las com o ponto de ebulição das substâncias. Denomina-se ponto de ebulição a temperatura na qual as moléculas de uma determinada substância deixam de estar no estado líquido (têm suas forças intermoleculares rompidas) e passam para o estado gasoso. O detalhe interessante é o de que as forças intermoleculares e o ponto de ebulição de substâncias apresentam uma relação muito intensa e direta, já que, quanto mais intensa for a força intermolecular, maior será o ponto de ebulição. A ordem de intensidade das forças intermoleculares é:
Dipolo induzido < Dipolo-dipolo < Ligações de hidrogênio
Assim, podemos concluir que as moléculas que apresentam ligações de hidrogênio como força de interação possuem pontos de ebulições mais altos que as que possuem dipolo-dipolo e assim por diante. O quadro a seguir apresenta três substâncias e os valores de seus pontos de ebulição:
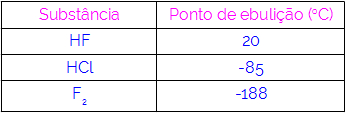
Observamos na tabela que o HF apresenta maior ponto de ebulição, pois suas moléculas estão unidas por ligações de Hidrogênio. A substância F2 apresenta o menor ponto de ebulição, uma vez que suas moléculas são atraídas por dipolo induzido.
Por Me. Diogo Lopes Dias