A polaridade das moléculas é um aspecto muito importante, pois as características das substâncias são determinadas, entre outros fatores, pelo fato de suas moléculas serem polares ou apolares.
A determinação da polaridade de uma molécula pode ser realizada por meio do Momento de Dipolo ou Momento Dipolar Resultante, cujo símbolo é 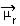 . Se estivermos falando apenas do momento dipolar de cada ligação da molécula, nesse caso o símbolo é a letra grega mi (µ).
. Se estivermos falando apenas do momento dipolar de cada ligação da molécula, nesse caso o símbolo é a letra grega mi (µ).

A molécula será apolar se o momento dipolar for igual a zero, mas se for diferente de zero, significa que ela é polar.

Existem duas coisas importantes a se considerar na determinação desse momento dipolar resultante. Vejamos quais são:
1) Diferença de eletronegatividade entre os átomos dos elementos participantes da reação. Por exemplo, a molécula de HF apresenta uma acentuada diferença de eletronegatividade, pois o flúor atrai, muito mais que o hidrogênio, o par de elétrons da ligação. Dessa maneira, a distribuição das cargas não é simétrica, apresentando dipolos elétricos.
Esse dipolo é representado por um vetor que fica virado para a extremidade que concentra mais os elétrons, ou seja, do átomo menos para o mais eletronegativo. Assim, nesse caso, o vetor, que é o único, será o vetor resultante, conforme indicado abaixo:
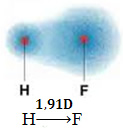
Observe que o valor do vetor é o mesmo do momento dipolar, que é dado na unidade debye (D= 3,33 . 10-30 coulomb . metro). Visto que o momento dipolar é diferente de zero, a molécula e a ligação são polares.
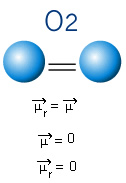
Na molécula abaixo, também temos uma molécula com apenas dois átomos, porém, nesse caso, ela corresponde a uma substância simples, ou seja, é formada por apenas um tipo de elemento. Portanto, não há diferença de eletronegatividade; os átomos atraem igualmente os elétrons, que estão distribuídos de maneira simétrica. O momento dipolar resultante é igual a zero e, por isso, tanto a ligação quanto a molécula são apolares.
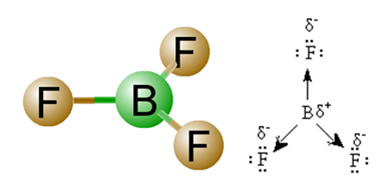
2) Geometria da molécula, ou seja, a disposição espacial dos vetores. A molécula do BF3 apresenta três ligações polares, em que o flúor é o mais eletronegativo, tendo, portanto, os vetores direcionados para ele. Porém, visto que a disposição espacial dos átomos é trigonal plana, isso faz com que os elétrons tenham uma distribuição simétrica ao redor do átomo central. Assim, o resultado é que esses três vetores se anulam e o momento dipolar é igual a zero. Por isso, a molécula do BF3 é apolar.
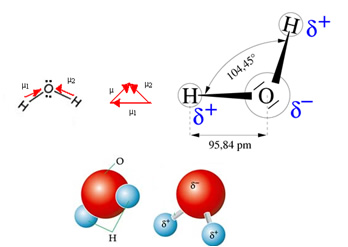
A molécula de água apresenta dois vetores, porém, a sua geometria espacial não é plana, mas sim no formato de V. Observe na figura a seguir que desse modo os seus vetores não se anulam, os elétrons ficam distribuídos de maneira assimétrica e mais concentrados no átomo mais eletronegativo, que é o oxigênio. Dessa forma, o momento dipolar é diferente de zero e a molécula de água é polar:
Por Jennifer Fogaça
Graduada em Química

