As forças intermoleculares são aquelas responsáveis por manterem moléculas unidas na formação dos diferentes compostos, estas forças influem sobre o estado físico e a temperatura das substâncias, veja como:
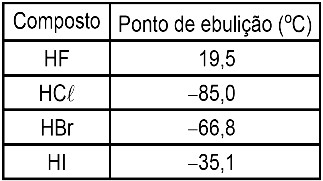
1. A temperatura de ebulição (T.E.) de uma substância é influenciada pela interação intermolecular que ocorre entre suas moléculas: quanto mais intensa for esta força maior será a T.E.

Ordem crescente da intensidade de interação →
2. As interações exercidas entre moléculas obedecem também ao estado físico das substâncias.
Podemos encontrar compostos em diferentes estados físicos: sólido, líquido e gasoso. Mas você sabe por que eles se apresentam assim? Tudo depende da interação entre as moléculas, ou seja, em cada estado físico elas se organizam de uma determinada forma. Sabe-se também que uma substância pode mudar de estado físico, é aí que surge a dúvida: como as forças intermoleculares influem neste processo?
A desorganização das moléculas ocorre na passagem da substância de um estado físico para outro, por exemplo, sólido para o líquido (fusão), ou do líquido para o gasoso (vaporização). Durante este processo as forças intermoleculares são rompidas em razão do afastamento das moléculas.
Resumindo: Quanto menos intensas forem as forças intermoleculares, mais volátil será a substância e menor será a sua temperatura de ebulição (T.E.).
Em geral, um composto é considerado volátil em razão das suas fracas interações intermoleculares, neste caso as moléculas se afastam levando o líquido ao estado gasoso.
Por Líria Alves
Graduada em Química


.jpg)