Um composto (ou substância) polar é aquele que apresenta duas regiões com diferentes densidades eletrônicas. Uma dessas regiões possui caráter positivo (área branca), e outra possui caráter negativo (área amarela), como podemos observar na representação a seguir:
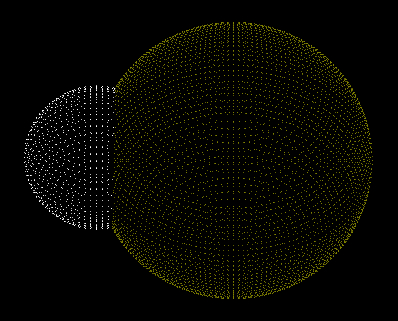
Representação das regiões de cargas diferentes em um composto polar
Saber se um determinado composto é polar implica conhecer o tipo de força intermolecular que favorece a interação entre suas moléculas ou com moléculas de outras substâncias, bem como realizar suposições quanto a sua solubilidade e pontos de fusão e ebulição.
Por exemplo: com relação à solubilidade, compostos polares apresentam boa capacidade de dissolver-se em compostos polares. Já quanto às forças intermoleculares, dependendo do caso, os compostos polares podem interagir por forças dipolo permanente ou ligações de hidrogênio (força que resulta também em maiores pontos de fusão e ebulição).
A seguir, conheça duas formas práticas para determinar se um composto é polar ou não.
Determinação da polaridade por meio do número de nuvens e número de ligantes
Podemos determinar se um composto é polar pela relação entre o número de átomos iguais ligados ao átomo central e o número de nuvens eletrônicas nesse átomo central.
Obs.: Nuvem eletrônica é toda ligação química entre dois átomos, ou um par de elétrons da camada de valência de um átomo que não estejam participando de uma ligação.
Se o número de nuvens presentes no átomo central for diferente do número de ligantes iguais desse átomo central, teremos um composto polar. Para compreender melhor, acompanhe os exemplos a seguir:
1º Exemplo: Molécula de ácido cianídrico
![]()
Fórmula estrutural do ácido cianídrico
No ácido cianídrico, o átomo central é o carbono, que apresenta quatro elétrons em sua camada de valência por pertencer à família IVA da tabela periódica. Como o carbono está realizando uma ligação simples (compartilhamento de dois elétrons, com um elétron de cada átomo envolvido) com o hidrogênio e uma ligação tripla com o nitrogênio, logo, não há elétrons não ligantes no átomo central.
Dessa forma, no ácido cianídrico, existe a presença de duas nuvens eletrônicas (uma ligação simples e uma ligação tripla) e ligante igual ao outro. Por isso, trata-se de um composto polar.
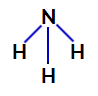
2º Exemplo: Molécula de amônia (NH3)
Na amônia, o átomo central é o nitrogênio, que apresenta cinco elétrons em sua camada de valência por pertencer à família VA da tabela periódica. Como o nitrogênio está realizando uma ligação simples (compartilhamento de dois elétrons, com um elétron de cada átomo envolvido) com cada átomo de hidrogênio, dois dos seus cinco elétrons não participam de ligações.
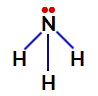
Elétrons não ligantes do nitrogênio na amônia
Dessa forma, na amônia, existem quatro nuvens eletrônicas (três ligações simples e o par de elétrons não ligantes) e três ligantes iguais (os três hidrogênios). Portanto, trata-se de um composto polar.
Determinação da polaridade por meio do vetor momento dipolar de um composto
Podemos determinar se um composto é polar pela análise do vetor momento dipolar resultante em sua fórmula estrutural, levando-se em consideração sua geometria molecular e a diferença de eletronegatividade entre os átomos envolvidos.
Obs.: Ordem decrescente de eletronegatividade dos elementos: F > O > N > Cl > Br > I > S > C > P > H.
Quando a soma dos vetores presentes na molécula for diferente de zero, o composto será polar. Para compreender melhor, acompanhe os seguintes exemplos:
1º Exemplo: molécula de triclorometano
O triclorometano é um composto que apresenta geometria tetraédrica, como podemos observar em sua fórmula estrutural a seguir:
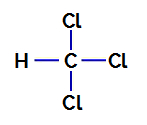
Fórmula estrutural do triclorometano
Para saber se é ou não um composto polar, devemos inicialmente posicionar os vetores momento dipolar (setas que indicam qual átomo é mais estável que o outro) na estrutural, como no exemplo a seguir:
Obs.: O cloro é um elemento mais eletronegativo que o carbono. Por sua vez, o carbono é um elemento mais eletronegativo que o hidrogênio.
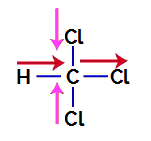
Vetores momento dipolar no triclorometano
Os vetores em rosa podem ser representados por +x e -x, já que apresentam a mesma direção (vertical) e sentidos contrários (para cima e para baixo). Os vetores em vermelho são representados por +x, pois apresentam o mesmo sentido e a mesma direção. Com isso, o vetor momento dipolar resultante (soma dos vetores) é representado por:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Como o vetor momento dipolar resultante é diferente de zero, temos um composto polar.
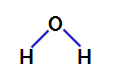
2º Exemplo: Molécula de água
A água é um composto que apresenta geometria angular, como podemos observar em sua fórmula estrutural a seguir:
Para saber se é ou não um composto polar, devemos inicialmente posicionar os vetores momento dipolar (setas que indicam qual átomo é mais estável que o outro) na estrutura, como representado a seguir:
Obs.: O oxigênio é um elemento mais eletronegativo que o hidrogênio.
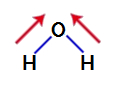
Vetores momento dipolar na água
Como os dois vetores na estrutura da água estão na diagonal, devemos utilizar a regra do paralelogramo. Nessa regra, ao ligarmos as bases dos vetores, temos a criação de um vetor resultante (que substitui os dois utilizados anteriormente), como no modelo a seguir:
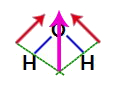
Vetor resultante na fórmula estrutural da água
Como a molécula de água apresenta um único vetor, logo, o vetor momento dipolar resultante é diferente de zero, ou seja, temos um composto polar.
Por Me. Diogo Lopes Dias