As moléculas são estruturas que possuem uma massa molar determinada e um número relativamente pequeno e exato de átomos ligados entre si covalentemente, ou seja, por meio do compartilhamento de elétrons.
Veja três exemplos:
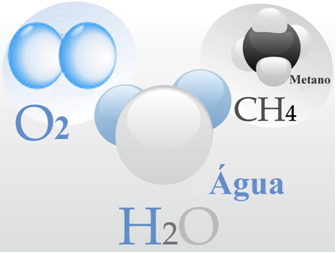
- Gás oxigênio: Suas moléculas são formadas cada uma por uma ligação dupla, isto é, pelo compartilhamento de dois pares de elétrons entre dois átomos de oxigênio (O2);
- Água: ela é formada por moléculas de H2O. O que significa que cada molécula possui dois átomos de hidrogênio compartilhando um par de elétrons cada um com um átomo de oxigênio.
- Metano: esse composto é formado por moléculas de CH4, em que quatro átomos de hidrogênio se ligam covalentemente a um átomo de carbono.
As substâncias moleculares possuem algumas propriedades características, tais como:
- Solubilidade variada em água e em outros solventes;
- Podem se apresentar nos três estados físicos;
- De modo geral, são isolantes elétricos, tanto no estado sólido como no líquido.
Todas as moléculas são formadas por elementos não metálicos, isto é, incluem somente o hidrogênio, os ametais e os semimetais. Mas esses elementos podem formar também substâncias que se apresentam somente no estado sólido e que possuem propriedades muito distintas às das moléculas. Estas são as macromoléculas.
As macromoléculas, também conhecidas como sólidos covalentes ou sólidos de rede covalente, são estruturas de massa molar bastante elevada e imprecisa, além de serem formadas por uma grande e indeterminada quantidade de átomos que se ligam covalentemente formando retículos tridimensionais. As macromoléculas formam os cristais covalentes ou cristais atômicos.
Por exemplo, os átomos de carbono podem compartilhar elétrons de várias formas e formar diversas substâncias simples diferentes. A essa propriedade que um mesmo elemento químico tem de formar duas ou mais substâncias simples diferentes é dado o nome de alotropia.
Duas variedades alotrópicas do carbono que formam macromoléculas são o diamante e a grafita. Nas imagens abaixo você poderá ver que, no caso do diamante, cada átomo de carbono se liga a outros quatro átomos de carbono e origina uma macromolécula com estrutura tetraédrica.

Enquanto isso, a estrutura da grafita é formada por anéis hexagonais contidos num mesmo plano. Os átomos de carbono realizam uma ligação dupla e duas simples.

Mas as macromoléculas não são formadas apenas por um único tipo de elemento; elas também podem ser formadas por átomos de elementos químicos diferentes.
Um exemplo é o dióxido de silício (quartzo), cujas macromoléculas possuem cada átomo de silício rodeado por quatro átomos de carbono e cada átomo de oxigênio ligado a dois átomos de silício.
Por Jennifer Fogaça
Graduada em Química
