Chamamos de polaridade a capacidade que as ligações possuem de atrair cargas elétricas, e o local onde ocorre este acúmulo denominamos de pólos, estes se classificam em pólos negativos ou positivos.
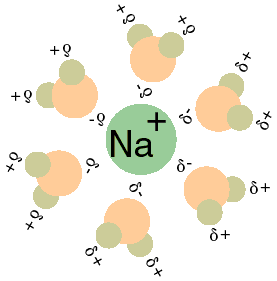
Vejamos agora a polaridade presente nas ligações iônicas e covalentes:
Ligação iônica: neste tipo de ligação a transferência de elétrons é definitiva e por isso os compostos iônicos, como o próprio nome já diz, são carregados de cargas positivas e negativas e, portanto, apresentam pólos. A esta definição se aplica a regra:
Toda ligação iônica é uma ligação polar.
Ligação covalente: os pólos neste caso estão associados à eletronegatividade.
- Se a ligação covalente for entre átomos de mesma eletronegatividade, a ligação será apolar, porque não ocorre formação de pólos.
Exemplo: Br ─ Br
Como se trata da ligação entre elementos iguais (Bromo) e com mesma eletronegatividade, o composto se classifica como apolar.
- Agora, se a ligação covalente for entre átomos com eletronegatividades diferentes, a ligação será polar. Esta diferença induz o acúmulo de carga negativa ao redor do elemento mais eletronegativo, gerando assim, pólos na molécula.
A escala de eletronegatividade de Pauling facilita nosso estudo:
.jpg)
A eletronegatividade é crescente no sentido da seta. Temos um memorando que pode auxiliar na memorização desta escala:
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”.
As letras em destaque representam os elementos em escala decrescente de eletronegatividade.
Quanto maior a diferença de eletronegatividade, maior será a polaridade da ligação.
Um exemplo: a molécula de água é composta por hidrogênio (H) e oxigênio (O). Repare que de acordo com a escala, o “O” se encontra em uma extremidade e o “H” na outra, ou seja, estão bem distantes. Sendo assim, a molécula de H2O é considerada polar, pois os elementos que a formam possuem eletronegatividades distintas.
Se fôssemos fazer uma comparação: qual ligação, a covalente ou iônica, possui maior polaridade? A ligação iônica apresenta polarização máxima, ou seja, nenhum outro composto é mais polarizado que o composto iônico.
Por Líria Alves
Graduada em Química

