O zircônio, símbolo Zr, número atômico 40, é um elemento químico pertencente ao grupo 5 da Tabela Periódica. Destaca-se por sua grande resistência à corrosão, além de boa estabilidade térmica.
O elemento é quimicamente muito semelhante ao háfnio, e, por conta disso, toda amostra natural de zircônio possui um pequeno teor de háfnio. É abundante na crosta terrestre, com um teor muito maior que o de elementos amplamente usados, como cobre, zinco e chumbo.
O zircônio tem grande aplicação na indústria nuclear, pois sua baixa absorção de nêutrons faz dele um excelente revestimento para o combustível, rico em dióxido de urânio. Além disso, por ser considerado atóxico e muito biocompatível, o zircônio é aplicado em próteses e implantes cirúrgicos.
Leia também: Urânio — elemento de grande importância para a geração de energia
Tópicos deste artigo
- 1 - Resumo sobre zircônio
- 2 - Propriedades do zircônio
- 3 - Características do zircônio
- 4 - Onde o zircônio pode ser encontrado?
- 5 - Obtenção do zircônio
- 6 - Aplicações do zircônio
- 7 - História do zircônio
- 8 - Exercícios resolvidos sobre o zircônio
Resumo sobre zircônio
-
O zircônio é um metal pertencente ao grupo 5 da Tabela Periódica.
-
Sempre se apresenta na natureza com um pequeno teor de háfnio, pois esses elementos são quimicamente muito semelhantes.
-
A zirconita e a baddeleyita são os principais minérios de zircônio.
-
A separação entre zircônio e háfnio é muito difícil.
-
O zircônio possui boa resistência à corrosão e a altas temperaturas.
-
Pode ser usado em implantes dentários e outras próteses, pois é atóxico e possui alta biocompatibilidade.
-
Boa parte do zircônio é utilizada pela indústria nuclear.
-
O elemento foi descoberto em 1789 pelo cientista alemão Martin Klaproth.
Propriedades do zircônio
-
Símbolo: Zr.
-
Número atômico: 40.
-
Massa atômica: 91,224 u.m.a.
-
Eletronegatividade: 1,33.
-
Ponto de fusão: 1855 °C.
-
Ponto de ebulição: 4409 °C.
-
Densidade: 6,52 g.cm-3 (a 20 °C).
-
Configuração eletrônica: 5s2 4d2.
-
Série Química: grupo 4, metais de transição.
Características do zircônio
O zircônio, em sua forma metálica, é um metal de coloração acinzentada e que apresenta boa resistência à corrosão, principalmente por causa da camada de ZrO2 que se forma em sua volta, protegendo a massa metálica interna. Contudo, se finamente dividido, o zircônio é altamente pirofórico, ou seja, pode entrar em ignição espontaneamente em contato com o ar, principalmente em altas temperaturas.
Quimicamente, o zircônio é muito próximo ao háfnio, até porque os elementos ocorrem conjuntamente na natureza. Portanto, assim como o háfnio, o zircônio não sofre ataques químicos de ácidos diluídos (exceto HF), a menos que estejam aquecidos. Já soluções alcalinas não possuem muita eficiência sobre o zircônio, mesmo em maiores temperaturas.
Em sistemas de maior temperatura, o zircônio tem a capacidade de reagir com a maioria dos ametais. Ao reagir, percebe-se que os compostos de zircônio com número de oxidação +4 são os mais estáveis, como é o caso do ZrO2 ou do ZrCl4. Estados de menor oxidação, como o +3, são menos estáveis, uma diferença em relação ao titânio, elemento mais leve do grupo 4, o qual apresenta boa estabilidade com essa carga.
Onde o zircônio pode ser encontrado?

Dentre os elementos do bloco d da Tabela Periódica, o zircônio é o quarto mais abundante, ficando atrás do ferro, titânio e manganês. Existem mais de 30 minérios que possuem zircônio em sua constituição. Dentre os mais conhecidos e importantes estão a zirconita (também conhecida como zircão), ZrSiO4, e a baddeleyita (ou baddeleíta), ZrO2. A baddeleyita, inclusive, é encontrada no Brasil.
Os países que concentram as maiores reservas de zircônio são a Austrália, África do Sul e Moçambique. Contudo, os maiores produtores são a China, França, Índia, Rússia, Alemanha e Estados Unidos.
Curiosamente, o zircônio é abundantemente encontrado em algumas estrelas. O elemento foi identificado até mesmo no Sol e em meteoritos. Amostras lunares obtidas através das missões Apollo comprovaram alto teor de ZrO2 nessas rochas quando comparadas com as terrestres.
Veja também: Ouro — metal nobre que se destaca por sua boa condutividade elétrica
Obtenção do zircônio
O zircônio ocorre naturalmente com o háfnio, sempre com um teor do segundo elemento que varia de 1 a 3% em massa. Apesar de baixo teor, a separação entre ambos é muito difícil.
Comumente, usa-se o processo Kroll para a extração do zircônio. Nesse processo, o ZrO2 contido nos minérios é convertido, em alta temperatura, em ZrCl4. Dessa forma, o zircônio pode ser obtido utilizando o magnésio como redutor. As reações a seguir demonstram o processo.
ZrO2 → ZrCl4 (usando CCl4 a 770 K de temperatura)
ZrCl4 → Zr (usando Mg em atmosfera de Ar a 1420 K de temperatura)
Porém, a grande semelhança química entre Zr e Hf faz com que o háfnio se mantenha no sistema final, como uma impureza persistente. Assim, é necessária a utilização de técnicas metalúrgicas para a separação entre Zr e Hf. A indústria já desenvolve rotas hidrometalúrgicas (ou seja, que ocorrem em solução aquosa) e pirometalúrgicas (sem a presença de água).
Uma técnica hidrometalúrgica é a cristalização fracionada dos sais K2ZrF6 e K2HfF6, os quais não possuem a mesma solubilidade em água. Outra técnica feita em solução é a extração com solvente, por meio da qual compostos de Zr e Hf são dissolvidos em água e então extraídos seletivamente com solventes orgânicos, como metilisobutilcetona e o fosfato de tributila. Dada a dificuldade de separação, o zircônio comercial é comumente comercializado com o teor de 1 a 3% em massa de Hf.
Aplicações do zircônio
O zircônio metálico é empregado em ligas, principalmente no aço, para torná-las melhores em termos de resistência mecânica e corrosiva. A estabilidade do metal em altas temperaturas também permite que ele seja utilizado em naves espaciais, as quais sofrem muitos danos por causa das condições extremas encontradas durante a reentrada na atmosfera terrestre.
Como o zircônio é reconhecido como um elemento atóxico e altamente resistente à corrosão, além de possuir boa biocompatibilidade, seu uso em aplicações cirúrgicas também é explorado, como em próteses e implantes dentários.
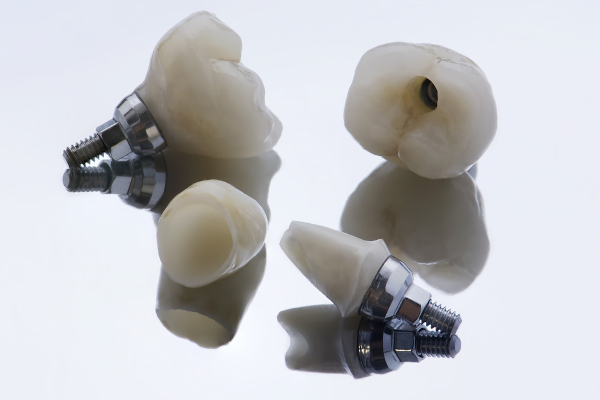
O dióxido de zircônio, ZrO2, possui um altíssimo ponto de fusão, na faixa de 2500 °C. Assim, ele é utilizado na fabricação de recipientes com grande resistência ao calor, além de cerâmicas altamente resistentes. Essas cerâmicas, inclusive, vêm sendo exploradas em maquinário de corte por esse motivo. O ZrO2 também pode ser usado em cosméticos, antitranspirantes, embalagens de alimentos e até mesmo em gemas falsas.
Vale destacar que boa parte do zircônio é utilizada pela indústria nuclear. Há, por exemplo, a liga Zircaloy®, uma liga metálica de zircônio e estanho desenvolvida exclusivamente para fins nucleares.
Na indústria nuclear, o zircônio é empregado nas embalagens que contêm óxido de urânio, combustível das usinas. Por ser altamente resistente à água e com baixa captura dos nêutrons, ele acaba sendo um bom material para esse fim. Vale lembrar que os nêutrons são utilizados durante a fissão, e, por isso, é essencial que o zircônio não os capture. A não captura também faz com que o zircônio não apresente radioatividade. É por conta disso que, nesse caso, o zircônio não pode ter traços de háfnio, metal que possui grande capacidade de captura de nêutrons.
Confira no nosso podcast: Como funcionam as usinas nucleares?
História do zircônio
O nome zircônio provavelmente deriva de zargono, palavra do idioma siríaco utilizada para descrever as cores de gemas que hoje são conhecidas como zircônias. Apesar dos minerais já serem conhecidos, não se sabia que eles continham um novo elemento, até que Martin Heirinch Klaproth, em 1789, conseguiu detectar o elemento em Berlim. O cientista alemão decidiu nomear o elemento de zirkornerde.
O ano de 1789 foi muito importante para Klaproth, pois nesse mesmo ano o cientista descobriu o elemento urânio.
Exercícios resolvidos sobre o zircônio
Questão 1
(FGV SP/2014 — adaptada) Uma nova e promissora classe de materiais supercondutores tem como base o composto diboreto de zircônio e vanádio. Esse composto é sintetizado a partir de um sal de zircônio (IV).
(Revista Pesquisa Fapesp, Junho 2013. Adaptado)
O número de prótons e de elétrons no íon Zr4+ é igual a, respectivamente:
A) 36; 40
B) 40; 40
C) 40; 44
D) 40; 36
E) 36; 36
Resposta
Letra D
Como o zircônio possui número atômico igual a 40, podemos concluir que seu número de prótons é também 40, pois o número atômico é numericamente igual ao número de prótons.
Apresentando carga igual a +4, sabemos que o zircônio nessa forma possui quatro elétrons a menos que na sua forma neutra.
Quando neutro, o número de prótons é igual ao número de elétrons, ou seja, originalmente o zircônio possui 40 prótons e 40 elétrons. Perdendo quatro elétrons, o zircônio fica apenas com 36.
Questão 2
(Uerj 2013 — adaptada) O dióxido de zircônio se assemelha ao diamante, uma forma alotrópica do carbono, podendo substituí-lo na confecção de joias de baixo custo.
Marque a alternativa que contém a fórmula química do dióxido de zircônio, bem como o tipo de ligação interatômica dessa substância.
A) ZrO4, covalente.
B) ZrO2, iônica.
C) ZrO2, covalente.
D) ZrO4, iônica.
E) ZrO2, metálica.
Resposta
Letra B
O dióxido de zircônio, como o próprio nome deixa em evidência, deve conter apenas dois átomos de oxigênio. Assim, a fórmula esperada é ZrO2. Além disso, o zircônio comumente adquire o estado de oxidação igual a +4.
O tipo de ligação interatômica é iônica, por dois motivos:
-
o zircônio é um metal, e o oxigênio é um ametal;
-
a diferença de eletronegatividade entre ambos é maior que 1,7 (3,5 – 1,3 = 2,2).
Por Stéfano Araújo Novais
Professor de Química

