Eletroquímica é um ramo da Química em que se correlaciona o envolvimento de reações químicas com corrente elétrica e potencial elétrico. Algumas reações podem gerar corrente elétrica espontaneamente, enquanto outras podem necessitar de corrente elétrica para acontecer. Assim sendo, a eletroquímica estuda como mudanças químicas e elétricas ocorrem no sistema de acordo com a passagem de uma corrente elétrica.
A eletroquímica é um importante campo, pois ajuda a desenvolver tecnologias e materiais que atendem ao mundo moderno. Graças a ela, temos o desenvolvimento de baterias (como as de íon lítio), células solares, técnicas de produção de diversas substâncias químicas e metais pela eletrólise, além de técnicas de contenção da corrosão, um grande problema estrutural. As reações que ocorrem em processos eletroquímicos são chamadas de reações de oxirredução ou simplesmente de reações redox.
Leia também: Como é produzida a energia elétrica?
Tópicos deste artigo
- 1 - Resumo sobre eletroquímica
- 2 - O que é eletroquímica?
- 3 - O que a eletroquímica estuda?
- 4 - Reações de oxirredução
- 5 - Conceitos importantes de eletroquímica
- 6 - Onde é usada a eletroquímica?
- 7 - Eletroquímica no Enem
- 8 - Exercícios resolvidos sobre eletroquímica
Resumo sobre eletroquímica
- A eletroquímica é o ramo da Química que trabalha o envolvimento de reações químicas com corrente elétrica e potencial.
- Todo dispositivo em que uma corrente elétrica é produzida ou usada é chamado de célula eletroquímica.
- As reações químicas em processos eletroquímicos são chamadas de reações de oxirredução ou reações redox.
- A eletroquímica foi importante para o desenvolvimento das pilhas, que geram energia de forma espontânea, e para a eletrólise, que necessita de energia para desencadear o processo químico.
- Atende às demandas mais modernas da sociedade, desenvolvendo novos produtos, energias e tecnologias, tais como baterias, células a combustível, técnicas para a produção de insumos químicos e também técnicas de reparação de estruturas e de análises químicas.
O que é eletroquímica?
A eletroquímica é um ramo da Química (mais especificamente da Físico-Química) que lida com reações químicas que envolvem corrente elétrica e potencial. Enquanto algumas reações podem, espontaneamente, gerar corrente elétrica para realizar trabalho útil, outras podem necessitar de corrente elétrica para prosseguirem.
O que a eletroquímica estuda?
A eletroquímica estuda como mudanças químicas e elétricas no sistema podem ocorrer pela passagem de corrente. Define-se como célula eletroquímica todo dispositivo em que uma corrente elétrica é produzida via reação química espontânea ou é usada para forçar a ocorrência de uma reação não espontânea.
A célula eletroquímica em que ocorre corrente produzida via reação espontânea é chamada de célula galvânica, em homenagem ao cientista italiano Luigi Galvani, pioneiro nos estudos da eletricidade. Já a célula eletroquímica em que a energia elétrica é utilizada para força uma reação química é chamada de célula eletrolítica.

De modo geral, são os estudos em eletroquímica que nos permitiram desenvolver modernas tecnologias, como a geração de energia para dispositivos móveis e veículos automotores.
Veja também: Geradores elétricos — dispositivos capazes de produzir energia elétrica
Reações de oxirredução
As reações de oxirredução (ou reações redox) são assim chamadas porque englobam duas semirreações importantes, que ocorrem de forma concomitante: a de oxidação e a de redução.
Durante uma reação de oxirredução ocorre a transferência de um ou mais elétrons de uma espécie oxidada (a qual perde elétrons) para uma espécie reduzida (a qual ganha elétrons).
Por exemplo, vê-se a reação de oxirredução a seguir:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
Para fins didáticos, pois os elétrons nunca ficam isolados, podemos escrever apenas a reação de oxidação do zinco:
Zn (s) → Zn2+ (aq) + 2 e–
Perceba que o zinco perdeu, durante a oxidação, dois elétrons da sua estrutura e teve seu número de oxidação aumentado durante o processo (passou de 0 para +2).
Já o cobre, ao contrário, sofre uma redução, conforme podemos ver na semirreação de redução a seguir:
Cu2+ (aq) + 2 e– → Cu (s)
Veja que o cobre recebeu os dois elétrons em sua estrutura e teve seu número de oxidação reduzido durante o processo (passou de +2 para 0).
Durante a representação das semirreações os elétrons aparecem; contudo, ao representar o processo global (o somatório entre o processo de oxidação e redução, ou seja, a própria reação de oxirredução) os elétrons não podem aparecer, pois, mais uma vez, os elétrons nunca ficam isolados.
Conceitos importantes de eletroquímica
→ Pilha de Volta
A primeira contribuição da eletroquímica foi a pilha desenvolvida pelo cientista italiano Alessandro Volta. Ela possuía esse nome por se tratar de discos dos metais zinco e prata empilhados de formas alternadas, os quais eram separados por folhas de papel embebidas com solução de cloreto de sódio. Foi o primeiro dispositivo de armazenamento de eletricidade.
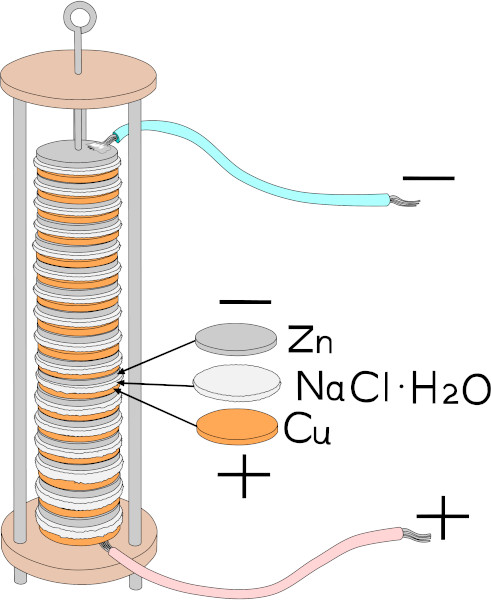
→ Pilha de Daniell
Foi desenvolvida pelo cientista inglês John Frederic Daniell, no ano de 1836, servindo de modelo para as pilhas posteriores. Não mais no layout da pilha de Volta, a célula galvânica desenvolvida por Daniell utiliza uma reação espontânea de oxidação de zinco e redução de cobre para a geração de cerca de 1,1 V de potencial elétrico.
Nesta, os metais (ou condutores metálicos) são chamados de eletrodos: o zinco, que é o eletrodo em que ocorre a oxidação, é chamado de ânodo (ou anodo); enquanto o cobre, que é o eletrodo em que ocorre a redução, é chamado de cátodo (ou catodo). Assim sendo, os elétrons migram do eletrodo de zinco em direção ao eletrodo de cobre, dando origem a uma corrente elétrica capaz de realizar trabalho elétrico.
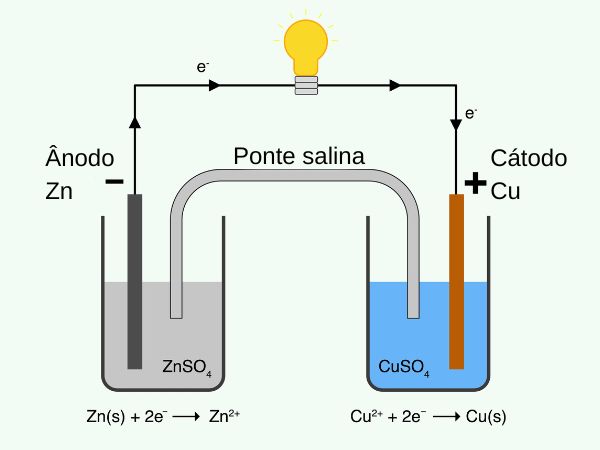
Tais eletrodos estão ligados por um fio conector, porém imersos, cada um, em uma respectiva solução chamada de solução eletrolítica (um meio condutor iônico): o zinco metálico em uma solução de sulfato de zinco (rica em íons Zn2+) e o cobre metálico em uma solução de sulfato de cobre (rica em íons Cu2+).
Em uma solução eletrolítica, a corrente elétrica é carregada pela movimentação dos íons. Assim sendo, as soluções de sulfato de zinco e cobre estão conectadas para fechar o circuito, seja por uma parede membranosa, seja por uma ponte salina, que também possuem a função de manter a eletroneutralidade do sistema.
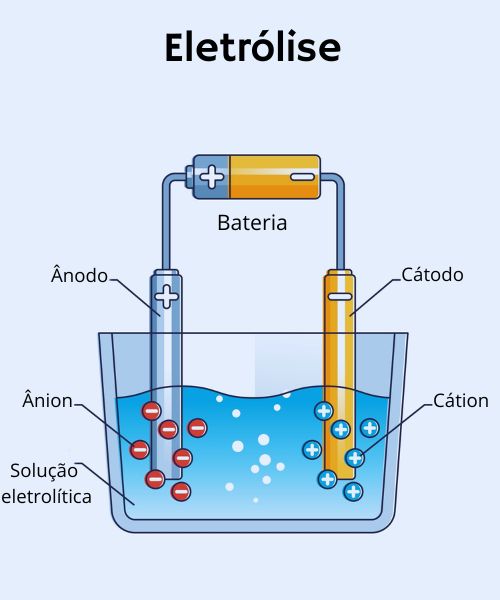
→ Eletrólises
São reações redox não espontâneas, sendo necessária a utilização da corrente elétrica para direcioná-las no sentido direto da formação dos produtos desejados. A eletrólise pode ocorrer na presença de água ou não (ígnea).
→ Diferença de potencial (ddp)
O potencial está atrelado à capacidade de puxar ou empurrar elétrons em uma reação. Quanto maior for essa capacidade, maior será o potencial elétrico e maior será a voltagem. Quando uma pilha (ou uma bateria) descarrega, não há mais como haver movimentação dos elétrons (o sistema atingiu o equilíbrio), e, nesse caso, dizemos que o potencial elétrico é zero. Agora, uma pilha nova, no início de sua vida útil, apresenta uma grande diferença de potencial, a qual vai diminuindo, até zero, até o fim de sua vida útil.
Embora não pareça possível, a diferença de potencial acaba sendo um parâmetro termodinâmico importante para determinar se o processo é espontâneo ou não. Caso o valor da ddp (também representado por ∆E) seja positivo, estamos diante de um processo espontâneo (uma célula galvânica).
Do contrário, se o ∆E calculado for negativo, então estamos diante de um processo não espontâneo (uma célula eletrolítica). Um valor negativo indica o ∆E mínimo necessário que devemos aplicar para conseguir reverter o processo e assim iniciá-lo.
Onde é usada a eletroquímica?
A eletroquímica tem grande importância na sociedade atual, respondendo às demandas do mundo contemporâneo. Auxilia no desenvolvimento de novos materiais, novas formas de energia e importantes formas de técnicas de análises laboratoriais.
É graças à eletroquímica que tivemos grandes avanços no campo do desenvolvimento das baterias (como as famosas de íon lítio), células solares, células a combustível, além da produção de diversas substâncias químicas, boa parte delas pela eletrólise, como hidrogênio, gás cloro, hidróxido de sódio, além de diversos metais, como alumínio, cobre, zinco, prata, chumbo, entre outros.

É a eletroquímica que também auxilia em um grande problema do cotidiano, que é a corrosão. A corrosão causa grandes danos estruturais nas instalações metálicas, como pontes, edifícios, tubulações e outras, necessitando de reparos constantes e consumindo grande parte do orçamento público dos entes federativos.
São técnicas eletroquímicas, como a galvanização e a proteção catódica, que minimizam os impactos da corrosão nas estruturas, fazendo economizar importantes recursos públicos.
Saiba mais: Como ocorre a eletrólise aquosa?
Eletroquímica no Enem
Segundo a Matriz de Referência do Exame Nacional do Ensino Médio, a eletroquímica está sim contemplada nos objetos de conhecimento associados à Química, mais especificamente nos seguintes tópicos:
- Transformações Químicas e Energia:
- transformações químicas e energia elétrica;
- reação de oxirredução;
- potenciais-padrão de redução;
- pilha;
- eletrólise;
- leis de Faraday.
- Relações da Química com as Tecnologias, a Sociedade e o Meio Ambiente:
- indústria química: obtenção e utilização do cloro, hidróxido de sódio;
- mineração e metalurgia.
→ Videoaula sobre eletroquímica no Enem
Exercícios resolvidos sobre eletroquímica
Questão 1
(Enem 2017) A eletrólise é um processo não espontâneo de grande importância para a indústria química. Uma de suas aplicações é a obtenção do gás cloro e do hidróxido de sódio, a partir de uma solução aquosa de cloreto de sódio. Nesse procedimento, utiliza-se uma célula eletroquímica, como ilustrado.
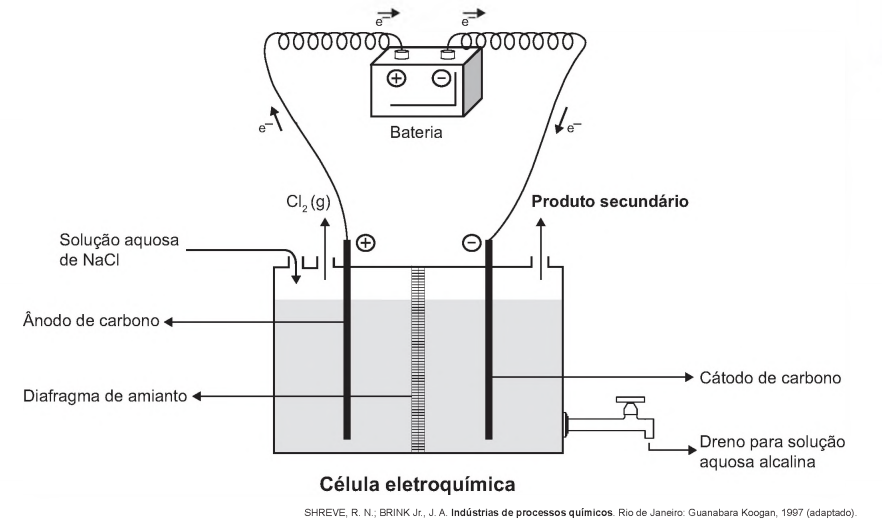
No processo eletrolítico ilustrado, o produto secundário obtido é o
a) vapor de água.
b) oxigênio molecular.
c) hipoclorito de sódio.
d) hidrogênio molecular.
e) cloreto de hidrogênio.
Resposta: Letra D.
Antes do início da eletrólise do NaCl, as espécies se ionizam:
NaCl (s) → Na+ (aq) + Cl– (aq)
H2O (l) → H+ (aq) + OH– (aq)
Percebe-se que o Cl2 é formado no polo positivo da bateria, ou seja, lá o Cl– é oxidado a Cl2, sendo este então o ânodo:
2 Cl– (aq) → Cl2 (g) + 2 e–
Com isso, o íon hidróxido (OH–) já não pode mais ser oxidado no ânodo e então sobra na solução. Resta saber qual espécie positiva vai sofrer a redução no cátodo (no caso, no polo negativo).
Ao avaliar a célula eletroquímica, percebe-se que há um dreno para solução aquosa alcalina, indicando, então, que essa solução é básica (pH > 7). Dentre as espécies possíveis, o único jeito para haver uma solução aquosa alcalina é que esse dreno seja composto por Na+ e OH–, pois se fosse feito por H+ e OH–, tal dreno seria neutro (e não alcalino).
Isso nos leva a concluir que a espécie positiva que migra para o polo negativo é o íon H+, onde sofrerá redução:
2 H+ (aq) + 2e– → H2 (g)
Assim sendo, o produto secundário é o gás hidrogênio.
Questão 2
(Enem 2019) Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando à produção de dispositivos para a geração de energia elétrica. Dentre eles, podem-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
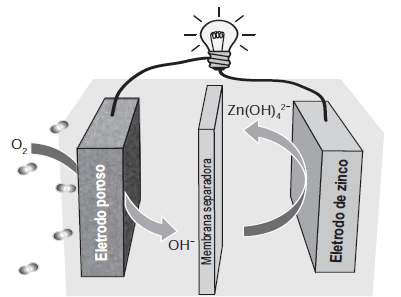
No funcionamento da bateria, a espécie química formada no ânodo é
a) H2 (g).
b) O2 (g).
c) H2O (l).
d) OH − (aq).
e) Zn(OH)42− (aq).
Resposta: Letra E.
O ânodo é o eletrodo em que ocorre a oxidação.
Percebe-se que no eletrodo poroso o O2 está sendo reduzido de O2 (NOx igual a 0 para o átomo de oxigênio) para OH– (NOx igual a -2 para o átomo de oxigênio). Já no eletrodo de zinco, o Zn inicia como substância simples (NOx igual a 0) e termina como Zn(OH)42, ou seja, com NOx igual a +2 para o zinco, indicando que houve uma oxidação.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INSTITUTO NACIONAL DE ESTUDOS E PESQUISAS EDUCACIONAIS ANÍSIO TEIXEIRA – INEP. Matriz de Referência ENEM. Disponível em: https://download.inep.gov.br/download/enem/matriz_referencia.pdf.
ZANONI, M. V. B. et al. Panorama da Eletroquímica e Eletroanalítica no Brasil. Química Nova. v. 40, n. 6. p. 663-669, 2017.