Sais inorgânicos são formados pela associação iônica de pelo menos um cátion (formado por metal qualquer ou pelo amônio) e um ânion (simples ou composto).
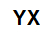
Fórmula molecular geral de um sal
Quando adicionados à água, os sais sofrem dissociação, liberando pelo menos um cátion diferente do hidrônio (H+) e um ânion diferente do hidróxido (OH-).
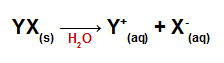
Equação da dissociação de um sal qualquer
Os sais, de forma geral, podem apresentar as seguintes classificações:
-
Sal simples: sal formado por apenas um cátion e um ânion. Exemplos: NaCl, CaSO4, KCN, NH4CO3 etc.
Não pare agora... Tem mais depois da publicidade ;) -
Sal hidrogenado: apresenta dois cátions (sendo um deles obrigatoriamente o hidrônio) e um ânion. Exemplos: NaHCO3, CaHBO3 etc.
-
Sal hidroxilado: apresenta um cátion e dois ânions (sendo um deles obrigatoriamente o hidróxido). Exemplos: MgOHCl, Al(OH)2ClO3 etc.
-
Sal hidratado: apresenta moléculas de água associadas à sua estrutura cristalina. Exemplos: CaCl2.2H2O, CuSO4.6H2O etc.
-
Sal duplo: apresenta dois cátions (todos diferentes do hidrônio) e um ânion ou um cátion e dois ânions (todos diferentes do hidróxido). Exemplos: TiPO4CN, AgFeBO3 etc.
-
Alúmen: é o sal formado por dois sulfatos com cátions de NOX igual a +1 e +3, além de 24 moléculas de água. Exemplos: Ag2SO4.Al2(SO4)3.24H2O, Na2SO4.Sb2(SO4)3.24H2O
Regra de nomenclatura dos sais
Nome do ânion + de + nome do cátion
→ K3PO4
O sal apresenta o ânion fosfato (PO4-3) e o cátion potássio (K+1), logo, seu nome é fosfato de potássio.
→ CaSO3
O sal apresenta o ânion sulfito (SO3-2) e o cátion cálcio (Ca+2), logo, seu nome é sulfito de cálcio.
OBS.: Se o cátion não for a prata, o zinco ou um elemento que pertença às famílias IA, IIA e IIIA, devemos indicar seu NOX com um algarismo romano na frente do nome do cátion.
→ Cu2SO4
O sal apresenta o ânion sulfato (SO4-2) e o cátion cálcio (Cu+1), logo, seu nome é sulfato de cobre I.
-
Sal hidrogenado: Para esse sal, antes do nome do ânion, devemos escrever o prefixo referente à quantidade de hidrogênios na fórmula. Esse prefixo deve ser separado da palavra hidrogeno por um hífen.
→ NaHCO3
O sal apresenta um hidrogênio, o ânion carbonato e o cátion sódio, logo, seu nome é mono-hidrogeno-carbonato de sódio.
-
Sal hidroxilado: Para esse sal, antes do nome do ânion, devemos escrever o prefixo referente à quantidade de hidroxilas na fórmula. Esse prefixo deve ser separado da palavra hidróxi por um hífen.
Não pare agora... Tem mais depois da publicidade ;)
→ Al(OH)2ClO3
O sal apresenta duas hidroxilas, o ânion clorato e o cátion alumínio, logo, seu nome é di-hidróxi-clorato de alumínio.
-
Sal hidratado: Para esse sal, após o nome do cátion, devemos escrever o prefixo referente à quantidade de moléculas de água na fórmula. Esse prefixo deve ser separado da palavra hidratado por um hífen.
→ CaCl2.2H2O
O sal apresenta duas moléculas de água, o ânion cloreto e o cátion cálcio, logo, seu nome é cloreto de cálcio di-hidratado.
-
Sal duplo com dois cátions: Para esse sal, devemos escrever a palavra duplo entre parênteses após o nome do ânion e, em seguida, o nome do cátion mais eletropositivo e o outro cátion.
Não pare agora... Tem mais depois da publicidade ;)
→ AgFeBO3
Esse sal apresenta a prata (cátion mais eletropositivo) e o cátion ferro II, além do ânion borato. Seu nome é borato (duplo) de prata e ferro II.
-
Sal duplo com dois ânions:
Nome do ânion mais eletronegativo + hífen + nome do ânion menos eletronegativo + de + nome do cátion
→ TiPO4CN
Esse sal apresenta o cátion titânio IV, além do fosfato (ânion mais eletronegativo) e do ânion cianeto. Seu nome é fosfato-cianeto de titânio IV.
-
Sal alúmen: Para esse sal, ignoramos a regra geral. Basta escrever o termo alúmen seguido do nome do cátion de carga +3 e do nome do cátion de carga +1, respectivamente, separados pela conjunção e.
→ Na2SO4.Sb2(SO4)3.24H2O
O sal alúmen apresenta o cátion +3 antimônio e o cátion + 1 sódio, logo, o seu nome é alúmen de antimônio III e sódio.
Características físicas dos sais
-
São sólidos em temperatura ambiente;
-
Possuem elevados pontos de fusão e ebulição;
Não pare agora... Tem mais depois da publicidade ;) -
São formados a partir de ligações iônicas;
-
Conduzem corrente elétrica no estado líquido (após sofrer fusão) ou quando dissolvidos em água;
-
De forma geral, são solúveis em água, mas existem sais que são considerados praticamente insolúveis.
Propriedades químicas dos sais
Os sais são compostos que apresentam a capacidade de reagir quimicamente (desde que não apresentem o mesmo cátion ou o mesmo ânion da outra substância) com diversos grupos de substâncias, a saber:
-
Em uma reação de dupla troca com um ácido: formam um novo sal e um novo ácido.
Não pare agora... Tem mais depois da publicidade ;) -
Em uma reação de dupla troca com uma base: formam um novo sal e uma nova base.
-
Em uma reação de dupla troca com outro sal: formam dois novos sais.
Alguns sais possuem a capacidade de sofrer decomposição quando submetidos ao calor, formando duas ou mais substâncias novas. Se aquecermos o bicarbonato de sódio (NaHCO3), por exemplo, ele sofrerá decomposição, formando o carbonato de sódio (Na2CO3), água (H2O) e gás carbônico (CO2).
Por Me. Diogo Lopes Dias
