A reação de dupla troca entre sais é o nome dado ao fenômeno químico que ocorre sempre que realizamos a mistura de dois sais que não apresentam o mesmo cátion nem o mesmo ânion. O resultado dessa reação é sempre a formação de dois novos sais.
a) Critério para a ocorrência de uma reação de dupla troca entre sais
A fórmula geral de um sal é XY, em que X (o primeiro componente da fórmula do sal) é sempre o cátion e Y (o segundo componente da fórmula do sal) é o ânion.
Se misturarmos em um recipiente, por exemplo, uma solução de cloreto de sódio (NaCl) e outra solução de iodeto de sódio (NaI), não acontecerá a reação de dupla troca porque o cátion (sódio - Na) presente nos dois sais é o mesmo.
Agora se misturarmos em um mesmo recipiente uma solução de cloreto de sódio (NaCl) e uma solução de iodeto de potássio (KI), acontecerá a reação de dupla troca porque os cátions (Sódio - Na e Potássio - K) e os ânions (Cloreto - Cl e Iodeto - I) presentes nos sais são diferentes.
b) Determinação da carga do cátion e do ânion de um sal
- Para sal sem índice na fórmula:
Quando não temos índice na fórmula de um sal, cátion e ânion apresentam o mesmo valor de carga, mas com sinais contrários. Assim, conhecendo a carga de um deles, a do outro apenas terá o sinal contrário.
Exemplo: CaS
Como o Ca é um metal alcalinoterroso, possui carga +2, assim, o S terá carga -2.
- Para sal com índice na fórmula:
Quando o sal possui índice na fórmula (no lado direito inferior da sigla de um elemento), automaticamente esse índice é a carga do grupo oposto.
Exemplo: CrCl3
Na fórmula, temos o índice 1 na frente do Cr e o índice 3 na frente do Cl, assim, a carga do Cr será +3 (positiva porque o primeiro grupo é o cátion) e carga do Cl será -1 (negativa porque o segundo grupo é sempre o ânion).
- Para sal com parênteses na fórmula:
Quando o sal possui índice na frente de parênteses, automaticamente, esse índice é a carga do grupo oposto.
Exemplo: Al2(SO4)3
Na fórmula temos o índice 2 na frente do Al e o índice 3 na frente do SO4, assim, a carga do Al será +3 (positiva porque o primeiro grupo é o cátion) e a carga do SO4 será -2 (negativa porque o segundo grupo é sempre o ânion).
c) Princípio de uma reação de dupla troca
A reação é chamada de dupla troca porque temos a troca de dois componentes entre os sais (XY e BA). O cátion (X) de um sal interage com o ânion (A) do outro sal, e o cátion (B) do outro interage com o ânion (Y) do primeiro, resultando na formação de dois novos sais (XA e BA). Podemos visualizar bem essa dupla troca na equação geral que representa esse tipo de reação química:
XY + BA → XA + BA
Na mistura entre as soluções de cloreto de sódio (NaCl) e iodeto de Potássio (KI), foram formados iodeto de sódio (NaI) e cloreto de potássio (KCl), como mostra a equação:
NaCl + KI → NaI + KCI
d) Alterações visuais de uma reação de dupla troca
Nem sempre quando realizamos uma reação de dupla troca, visualizamos alguma modificação no experimento. Em duas soluções aquosas incolores de sais, por exemplo, quando misturamos as duas, sabemos que novos sais foram formados, mas o resultado é um material incolor. A não alteração visual, portanto, não quer dizer que a reação de dupla troca não aconteceu.
Teremos uma alteração visual caso um ou dois sais praticamente insolúveis forem originados no processo. Se apenas sais solúveis forem formados, teremos alteração visual apenas se um dos sais dissolvidos alterar a cor da solução. A tabela abaixo traz informações sobre quando um sal é solúvel ou praticamente insolúvel:
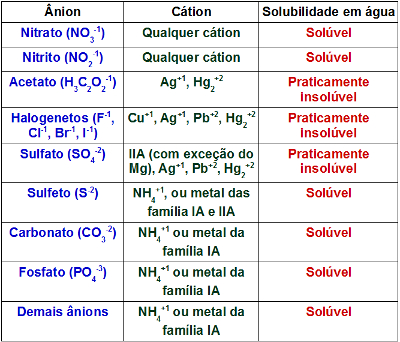
Tabela de solubilidade de sais
e) Exemplos de montagem de equações que representam reações de dupla troca entre sais
Acompanhe agora alguns exemplos da montagem de equação de reações de dupla troca entre sais:
Exemplo 1: Dupla troca entre cianeto de potássio (KCN) e cloreto de prata (AgCl)
Inicialmente vamos conhecer qual é o cátion e o ânion de cada um dos sais:
1) Para o KCN: Como não há índice escrito na fórmula, consideramos que há o índice 1 na frente do K e do CN.
- o cátion é o K+1 (+1 porque todo metal alcalino tem NOX +1);
- o ânion é CN-1 (-1 porque, quando os índices da fórmula são iguais, cátion e ânion apresentam cargas de mesmo valor, mas com sinais contrários).
2) Para o AgCl: Como não temos índice escrito na fórmula, consideramos que há o índice 1 na frente do Ag e do Cl.
- o cátion é o Ag+1 (+1 porque o Ag tem NOX fixo +1);
- o ânion é Cl-1 (-1 porque, quando os índices da fórmula são iguais, cátion e ânion apresentam cargas de mesmo valor, mas com sinais contrários).
Conhecendo os íons, fica fácil entender que a dupla troca entre esses sais ocorre com a união dos seguintes íons:
-
K+1 com Cl-1, resultando no sal KCl após o cruzamento das cargas +1 e -1 dos íons. Como as cargas apresentam o mesmo número (1), não é necessário escrevê-lo na fórmula final.
-
Ag+1 com CN-1, resultando no sal AgCN após o cruzamento das cargas +1 e -1 dos íons.
A equação química balanceada que representa a reação de dupla troca entre esses sais é:
1 KCN + 1 AgCl → 1 KCl + 1 AgCN
Nessa reação, temos a formação de um sal solúvel KCl (cloreto com metal alcalino) e outro praticamente insolúvel AgCN (cianeto, ânion qualquer, sem estar com metal alcalino ou NH4+). Assim, ao olhar para o experimento, veremos um sólido (AgCN) no fundo do recipiente, pois ele não se dissolve na água.
Exemplo 2: Dupla troca entre Carbonato de cálcio (CaCO3) e Sulfato de Magnésio (MgSO4)
Inicialmente vamos conhecer qual é o cátion e o ânion de cada um dos sais:
1) Para o CaCO3: Como não temos nenhum índice escrito na fórmula, a carga presente no cátion tem sempre o mesmo número que a carga do ânion.
- o cátion é o Ca+2 (+2 porque todo metal alcalinoterroso apresenta esse NOX);
- o ânion é o CO3-2 (-2 porque, como não temos nenhum índice escrito na frente do Ca, a carga do ânion terá o mesmo valor da carga do cátion, mas com sinal contrário).
2) Para o MgSO4: Como não temos nenhum índice escrito na fórmula, a carga presente no cátion tem sempre o mesmo número que a carga do ânion.
- o cátion é o Mg+2 (+2 porque todo metal alcalinoterroso apresenta esse NOX);
- o ânion é o SO4-2 (-2 porque, como não temos nenhum índice escrito na frente do Mg, a carga do ânion terá o mesmo valor da carga cátion, mas com sinal contrário).
Conhecendo os íons, fica fácil entender que a dupla troca entre esses sais ocorre com a união dos seguintes íons:
-
Ca+2 com SO4-2, resultando no sal CaSO, após o cruzamento das cargas +2 e -2 dos íons.
-
Mg+2 com CO3-2, resultando no sal MgCO3 após o cruzamento das cargas +2 e -2 dos íons.
A equação química balanceada que representa a reação de dupla troca entre esses sais é:
1 CaCO3 + 1 MgSO4 → 1 CaSO4 + 1 MgCO3
Nessa reação, temos a formação de dois sais praticamente insolúveis: o CaSO4 (sulfato com metal alcalinoterroso) e o MgCO3 (carbonato, sem estar com metal alcalino ou NH4+). Assim, ao olhar para o experimento, veremos dois sólidos (CaSO4 e MgCO3) no fundo do recipiente, pois eles não se dissolvem na água.
Exemplo 3: Dupla troca entre nitrato de sódio (NaNO3) e dicromato de potássio (K2Cr2O7)
Inicialmente vamos conhecer qual é o cátion e o ânion de cada um dos sais:
1) Para o NaNO3: Como não temos nenhum índice escrito na fórmula, consideramos que há nela o índice 1 na frente do Na e do NO3.
- o cátion é o Na+1 (+1 porque todo metal alcalino tem NOX +1);
- o ânion é o NO3-1 (-1 porque, quando os índices da fórmula são iguais, cátion e ânion apresentam cargas de mesmo valor, mas com sinais contrários).
2) Para o K2Cr2O7
- o cátion é o K+1 (+1 porque todo metal alcalino tem NOX +1);
- o ânion é o Cr2O7 -2 (-2 por termos o índice 2 no K).
Conhecendo os íons, fica fácil entender que a dupla troca entre esses sais ocorre com a união dos seguintes íons:
-
Na+1 com Cr2O7 -2, resultando no sal Na2Cr2O7 após o cruzamento das cargas +1 e -2 dos íons.
Não pare agora... Tem mais depois da publicidade ;) -
K+1 com NO3-1, resultando no sal KNO3 após o cruzamento das cargas +1 e -1 dos íons.
A equação química balanceada que representa a reação de dupla troca entre esses sais é:
2 NaNO3 + 1 K2Cr2O7 → 1 Na2Cr2O7 + 2 KNO3
Nessa reação, temos a formação de dois sais solúveis: o Na2Cr2O7 (dicromato, ânion qualquer, com metal alcalino) e o KNO3 (Nitrato, que sempre é solúvel). Assim, ao olhar para o experimento, não veremos nenhum sólido no fundo, mas, dependendo do sal que se dissolver, poderá haver mudança na coloração da solução (não é o caso do exemplo).
Exemplo 4: Dupla troca entre nitrito de ouro III [Au(NO2)3] e acetato de zinco [Zn(H3C2O2)2]
Inicialmente vamos conhecer qual é o cátion e o ânion de cada um dos sais:
1) Para o Au(NO2)3
- o cátion é o Au+3 (+3 por causa do índice 3 após os parênteses do NO2);
- o ânion é o NO2-1 (-1 por causa do índice 1 no Au).
2) Para o Zn(H3C2O2)2
- o cátion é o Zn+2 (+2 por causa do 2 após os parênteses do ânion);
- o ânion é o H3C2O2-1 (-1 por causa do índice 1 no Zn).
Conhecendo os íons, fica fácil entender que a dupla troca entre esses sais ocorre com a união dos seguintes íons:
-
Au+3 com H3C2O2-1, resultando no sal Au(H3C2O2)3 após o cruzamento das cargas +2 e -1 dos íons;
-
Zn+2 com NO2-1, resultando no sal Zn(NO2)2 após o cruzamento das cargas +2 e -1 dos íons.
A equação química balanceada que representa a reação de dupla troca entre esses sais é:
2 Au(NO2)3 + 3 Zn(H3C2O2)2 → 2 Au(H3C2O2)3 + 3 Zn(NO2)2
Nessa reação, temos um sal praticamente insolúvel, o Au(H3C2O2)3 (Acetato, ânion qualquer, sem estar com metal alcalino ou NH4+), e outro solúvel, o Zn(NO2)2 (Nitrito, que sempre é solúvel). Assim, ao olhar para o experimento, veremos um sólido no fundo do recipiente.
Por Me. Diogo Lopes Dias

