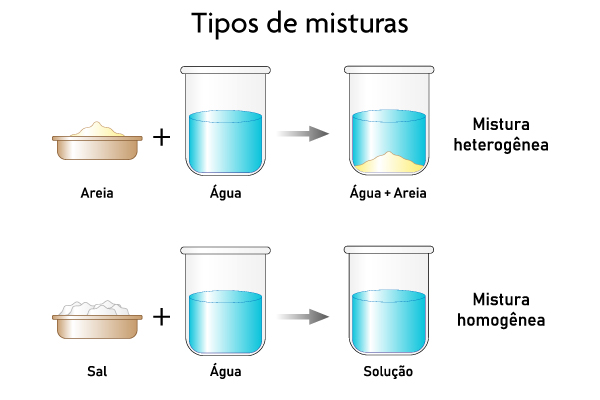
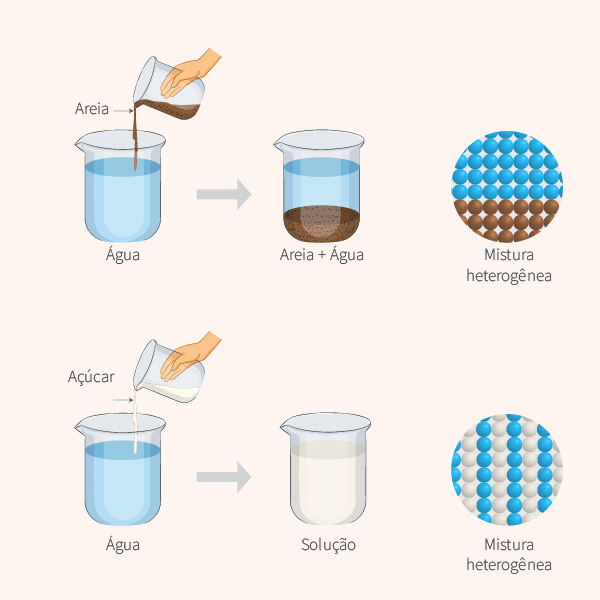
Misturas homogêneas e heterogêneas são tipos de misturas. Enquanto as homogêneas apresentam uma única fase e não possuem variação de suas propriedades no decorrer de sua extensão, as heterogêneas apresentam duas ou mais fases, o que leva a uma variação das suas propriedades.
Leia também: Soluções — misturas resultantes da união de duas ou mais substâncias diferentes
Tópicos deste artigo
- 1 - Resumo sobre misturas homogêneas e heterogêneas
- 2 - O que são misturas homogêneas e heterogêneas?
- 3 - Exemplos de misturas homogêneas e heterogêneas
- 4 - Misturas coloidais
- 5 - Métodos de separação de misturas
- 6 - Exercícios sobre misturas homogêneas e heterogêneas
Resumo sobre misturas homogêneas e heterogêneas
- Misturas homogêneas são aquelas que apresentam uma única fase, sem variação de suas propriedades no decorrer da extensão da mistura.
- Misturas heterogêneas são aquelas que apresentam duas ou mais fases e apresentam variação de suas propriedades no decorrer da extensão da mistura.
- A mistura de água e sal, ar atmosférico, aço, bronze, vinagre e gasolina são exemplos de misturas homogêneas.
- Água barrenta, sangue, leite, desodorantes, antitranspirantes, gelatina e tintas são exemplos de misturas heterogêneas.
- Misturas coloidais são sistemas heterogêneos formados por partículas não solúveis com tamanho variável entre 1 e 1000 nm que não podem ser vistas a olho nu.
- Os principais métodos de separação de misturas heterogêneas são: catação, ventilação; levigação; separação magnética; peneiração; flotação; floculação; fusão fracionada; solidificação fracionada; filtração; decantação; sifonação; dissolução fracionada e centrifugação;
- Os principais métodos de separação de misturas homogêneas são: destilação simples; destilação fracionada e evaporação.
O que são misturas homogêneas e heterogêneas?

As misturas homogêneas, também chamadas de soluções, apresentam uma única fase, além de não apresentarem variação em suas propriedades físico-químicas por toda a sua extensão. Isso ocorre devido à afinidade entre as substâncias misturadas, que decorre de forças intermoleculares de mesma intensidade, ou próxima, que atuam sobre cada molécula, fazendo com que a interação entre elas seja forte.
Nas misturas homogêneas, o soluto (substância em menor quantidade) está totalmente disperso entre as moléculas do solvente (substância em maior quantidade), devido ao tamanho das partículas do soluto, que são menores que 1 nm, o que cria uma uniformidade na mistura e gera o aspecto de única fase.
Já as misturas heterogêneas apresentam mais de uma fase e variação nas propriedades físico-químicas, assim uma fase apresenta propriedades diferentes da outra. Isso ocorre devido a uma baixa afinidade entre as moléculas misturadas e também porque as forças de atração que atuam em cada molécula são distintas uma da outra, gerando uma fraca atração.
As misturas heterogêneas ainda podem ser classificadas quanto ao número de fases, podendo ser:
- bifásicas: duas fases;
- trifásicas: três fases;
- polifásicas: mais de três fases.
As misturas heterogêneas também podem ser classificadas quanto ao tamanho das partículas insolúveis do disperso em:
- coloide: cujo tamanho médio das partículas varia de 1 a 1000 nm, não sendo visível a olho nu;
- suspensão: cujo tamanho das partículas é superior a 1000 nm, permitindo que as partículas sejam vistas a olho nu.
Exemplos de misturas homogêneas e heterogêneas
-
Exemplos de misturas homogêneas

- Água e sal: quando o sal é misturado na água, suas partículas se dispersam uniformemente pelas moléculas de água, gerando uma única fase transparente. A mesma coisa acontece ao se misturar água e açúcar ou água e etanol.
- Ar atmosférico: é uma mistura homogênea formada por cerca de 78% de gás nitrogênio (N2), 21% de gás oxigênio (O2) e 1% de argônio (Ar), além de outros gases poluentes, como dióxido de carbono (CO2), vapores de água e outros gases nobres, presentes em menor quantidade.
- Aço: é uma liga metálica formada por meio da mistura de ferro e carbono. Essa mistura apresenta um aspecto sólido e a uniformidade entre suas partículas a torna homogênea.
- Bronze: é uma liga metálica formada a partir da mistura de cobre (variando entre 85% e 95%) e estanho (variando entre 5% e 15%).
- Gasolina: é uma mistura homogênea de diferentes hidrocarbonetos que apresentam um aspecto líquido e uniforme.
- Vinagre: é uma solução aquosa de ácido acético muito utilizada na culinária para o preparo de diferentes pratos.
-
Exemplos de misturas heterogêneas

- Sangue: apesar de parecer uma mistura homogênea, com uma única fase, o sangue é um coloide formado pelo plasma e outras substâncias, como hemácias, leucócitos e plaquetas.
- Leite: mesmo que pareça apresentar uma única fase, o leite também é um coloide formado por mais de 100 substâncias que estão em solução, suspensão ou em emulsão com a água. Dentre essas substâncias, destacam-se os íons de cálcio e proteínas como albumina e caseína.
- Água barrenta: é uma mistura heterogênea composta principalmente por água, areia e barro, formada após chuvas e alagamentos.
- Desodorantes: são misturas heterogêneas formadas a partir de substâncias líquidas (fase dispersa) e gases (fase dispersante).
- Tintas: são misturas heterogêneas formadas entre uma substância sólida (fase dispersa) e uma substância líquida (fase dispersante).
- Gelatina: também é uma mistura heterogênea obtida por meio do colágeno dos ossos, cascos e tecidos de ligação de vacas ou porcos.
Leia também: Quais são os estados físicos da matéria?
Misturas coloidais
As misturas coloidais são sistemas heterogêneos intermediários entre as soluções e as suspensões. São formadas por partículas não solúveis com tamanho variável entre 1 e 1000 nm que não podem ser vistas a olho nu, apenas por meio de um microscópio.
Devido ao tamanho das partículas, as misturas coloidais apresentam um aspecto de turbidez que gera um espalhamento da luz, conhecido como efeito Tyndall.

O efeito Tyndall é gerado a partir da reflexão da luz por partículas que se encontram suspensas na solução coloidal. Esse efeito é percebido como uma “fresta de luz”, muito comum em lugares escuros com pequenas aberturas. Um exemplo bem comum é o espalhamento da luz emitida pelos faróis dos carros, gerado pelas partículas de sólidos suspensas no ar. O efeito é mais perceptível à noite.

Várias misturas coloidais estão presentes em nosso cotidiano, como o sangue, leite, gelatina, maionese, manteiga, tintas, desodorantes, antitranspirantes e géis, entre outras.
Métodos de separação de misturas
Como raramente as substâncias são encontradas puras na natureza, fez-se necessário o desenvolvimento de métodos de separação para isolar os diferentes componentes de cada tipo de mistura.
Os métodos são variados e são divididos com base na uniformidade da mistura e das propriedades físico-químicas das substâncias que as compõem.
Os principais métodos de separação de misturas heterogêneas são:
- Catação
- Ventilação
- Levigação
- Separação magnética
- Peneiração ou tamisação
- Flotação
- Floculação
- Fusão fracionada
- Solidificação fracionada
- Filtração
- Decantação sólido-líquido
- Decantação líquido-líquido ou extração líquido-líquido
- Sifonação
- Dissolução fracionada
- Centrifugação
Os principais métodos de separação de misturas homogêneas são:
- Destilação simples
- Destilação fracionada
- Evaporação
Para saber mais sobre os métodos de separação de misturas, leia: Separação de misturas.
Exercícios sobre misturas homogêneas e heterogêneas
Questão 1
(Enem 2024) O magnésio metálico utilizado em ligas leves é produzido em um processo que envolve várias etapas e utiliza água do mar como matéria-prima. A primeira etapa desse processo consiste na reação entre o íon Mg2+ e hidróxido de cálcio, Ca(OH)2, obtendo uma mistura que contém hidróxido de magnésio, pouco solúvel, e íons Ca2+, de acordo com a equação química:
Mg2+(aq) + Ca(OH)2(aq) → Mg(OH)2(s) + Ca2+(aq)
O método adequado para separar o Mg(OH)2 dessa mistura é a:
A) filtração.
B) catação.
C) destilação.
D) dissolução.
E) evaporação.
Resposta: letra A.
O enunciado diz que, no processo, é formado hidróxido de magnésio (Mg(OH)2) e que esse composto é insolúvel em água.
Esse fato é enfatizado na equação que descreve o processo, dada na questão:
Mg2+(aq) + Ca(OH)2(aq) → Mg(OH)2(s) + Ca2+(aq)
Perceba que a indicação do estado físico do Mg(OH)2, na equação, indica o estado sólido (s).
Dessa forma, o método mais adequado para remover o sólido da solução é a filtração (letra A), na qual a mistura é passada por filtro, permitindo que o líquido da solução escoe enquanto o sólido fica retido no filtro.
A catação (letra B) é um método utilizado para separar misturas do tipo sólido-sólido. Já a destilação e a evaporação (letras C e D) consistem em remover todo o solvente, o que não permitiria a separação do sólido, tendo em vista que, no final do processo, restaria dois sólidos misturados.
A dissolução (letra E) não é uma alternativa viável, pois os compostos já são formados em meio aquoso.
Questão 2
(Enem 2020) Em seu laboratório, um técnico em química foi incumbido de tratar um resíduo, evitando seu descarte direto no meio ambiente. Ao encontrar o frasco, observou a seguinte informação: “Resíduo: mistura de acetato de etila e água”.
Considere os dados do acetato de etila:
- baixa solubilidade em água;
- massa específica = 0,9 g.cm−3;
- temperatura de fusão = − 83 °C;
- pressão de vapor maior que a da água.
A fim de tratar o resíduo, recuperando o acetato de etila, o técnico deve:
A) evaporar o acetato de etila sem alterar o conteúdo de água.
B) filtrar a mistura utilizando um funil comum e um papel de filtro.
C) realizar uma destilação simples para separar a água do acetato de etila.
D) proceder a uma centrifugação da mistura para remover o acetato de etila.
E) decantar a mistura separando os dois componentes em um funil adequado.
Resposta: letra E.
Com base na baixa solubilidade do acetato e na sua massa específica (densidade), que é 0,9 g.cm−3 menor que a da água (d = 1 g.cm−3), podemos concluir que a mistura entre as duas substâncias formará duas fases líquidas.
A fase formada pelo acetato de etila é menos densa e ficará na parte de cima, enquanto a fase formada pela água é mais densa e ficará na parte de baixo.
Dessa forma, o método mais eficaz para separar os dois líquidos é a decantação líquido-líquido, realizada por meio do funil de separação (como proposto na letra E).
Atente ao fato de que a evaporação (letra A), a filtração (letra B), a destilação simples (letra C) e a centrifugação (letra D) são métodos de separação de misturas do tipo sólido-líquido, completamente diferente da mistura acetato de etila-água, em que ambas as substâncias estão no estado líquido.
Fontes
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1 & 2. 5 ed. Rio de Janeiro: LTC, 2003.
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
SKOOG, Douglas A (2006). Fundamentos de Química Analítica. 8ª ed. São Paulo-SP: Thomson.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.