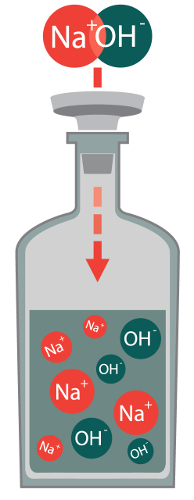
Dissociação das bases é um processo físico que ocorre com esse importante grupo de substâncias inorgânicas ao serem dissolvidas em água, ou quando passam pelo processo de fusão (passagem do estado sólido para o estado líquido por meio de aquecimento).
De uma forma geral, o fenômeno da dissociação das bases é a liberação dos cátions e dos ânions que formam o composto iônico, que, no caso, é a base. Assim, durante a dissociação das bases, ocorre a liberação de íons que já existem no composto, ou seja, não são formados novos íons.

A base é formada por um metal qualquer (X), que é o cátion do composto, ou pelo cátion amônio (grupo NH4+), ligado ao ânion hidróxido (representado pelo grupo OH), como nas representações abaixo:
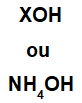
Representações gerais da fórmula de uma base
A forma de representar a dissociação das bases é feita por meio de uma equação em que, no reagente, temos a base e, nos produtos, temos os íons (cátions e ânions). O que diferencia é a forma como acontece a dissociação:
-
Dissolução da base em água:
![]()
Equação que representa a dissociação de uma base em meio aquoso
-
Dissociação por fusão da base:
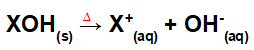
Equação que representa a dissociação de uma base pelo processo de fusão
Analisando as equações gerais acima, verificamos que em todas sempre teremos a base, o cátion (que é o metal ou grupo NH4+) e o ânion (OH-). Mas, são todas assim? Não existe nenhuma diferença entre elas? Para a primeira pergunta, a resposta é não e, para a segunda pergunta, a resposta é sim.
Quando realizamos a dissociação de uma base, é fundamental primeiramente analisar a fórmula da base, pois, a partir dela, podemos determinar a carga do cátion e a quantidade em mol de ânions hidróxido, já que a quantidade em mol de cátion é padrão (sempre 1 mol).
Vale lembrar que a quantidade de grupos OH, presentes na fórmula da base, determina a carga do cátion e a quantidade em mol do ânion hidróxido na dissociação da base.
Vejamos os exemplos do hidróxido de alumínio [Al(OH)3] e do hidróxido de ouro (AuOH). Na fórmula da base com alumínio, há três grupos OH, e na fórmula da base com ouro, apenas um grupo OH. Assim, na dissociação dessas bases, temos:
-
Dissociação do Al(OH)3:
Como essa base apresenta três grupos OH na fórmula, a carga do cátion será +3 e a quantidade em mol de ânions é igual a 3 mol, como podemos observar na equação a seguir:
![]()
Equação da dissociação da base com alumínio em meio aquoso
-
Dissociação do AuOH:
Como essa base apresenta um grupo OH na fórmula, a carga do cátion será +1 e a quantidade em mol de ânions é igual a 1 mol, como podemos observar na seguinte equação:
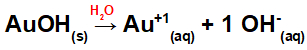
Equação da dissociação da base com ouro em meio aquoso
Por Me. Diogo Lopes Dias