A diluição é um procedimento laboratorial, industrial ou doméstico no qual um determinado volume de solvente (puro) é adicionado ou retirado (por meio de evaporação) de uma solução preexistente.
Em qualquer solução, sempre existe a presença de um solvente e pelo menos um soluto, como na mistura de 500 mL de água e 10 g de cloreto de sódio (NaCl) representada a seguir:
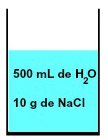
Representação da mistura formada por água e cloreto de sódio
Se adicionado a essa solução um volume de 300 mL de água, esse procedimento é chamado de diluição, pois o volume da solução aumenta – no caso, para 800 mL –, porém, sem alterar a quantidade de soluto.
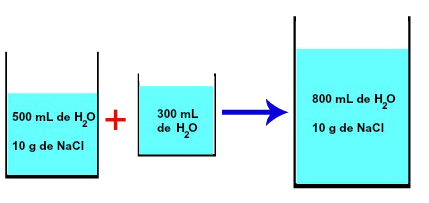
Diluição pela adição de solvente à solução salina
A diluição também pode ser realizada por meio do aquecimento dessa solução salina (composta por 500 mL de água e 10 g de NaCl) até que, por exemplo, 300 mL de água sejam vaporizados. Nesse caso, o volume da solução seria reduzido, entretanto, a quantidade de soluto não seria alterada.
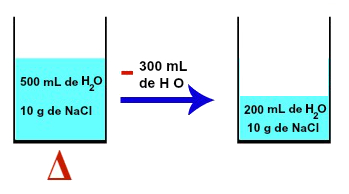
Diluição por meio da vaporização do solvente na solução salina
Princípios da diluição:
-
O volume final da solução, quando há adição de solvente, é sempre maior que o volume inicial;
-
O volume final da solução, quando há retirada de solvente, é sempre menor que o volume inicial;
-
A massa do soluto nunca é alterada durante a diluição de uma solução;
-
O número de mol do soluto nunca é alterado durante a diluição de uma solução;
-
Quando há adição de solvente a uma diluição, a concentração da solução final é sempre menor que a concentração da solução inicial;
-
Quando há retirada de solvente em uma diluição, a concentração da solução final é sempre maior que a concentração da solução inicial.
Fórmulas utilizadas na diluição
⇒ Cálculo do volume final da solução:
O volume da solução final em uma diluição em que há adição de solvente é calculado pela seguinte expressão:
Vf = Vi + Va
-
Vf = volume da solução final
-
Vi = volume da solução inicial
-
Va= volume de solvente que foi adicionado
Se houver a retirada de solvente em uma diluição, o volume final será calculado pela seguinte expressão:
Vf = Vi - Ve
-
Ve = volume de solvente evaporado.
⇒ Cálculo da concentração comum:
A concentração da solução final, após uma diluição, pode ser calculada da seguinte forma:
Ci.Vi = Cf.Vf
-
Ci= concentração comum da solução inicial
-
Vi = volume da solução inicial
-
Cf = molaridade ou concentração em mol/L da solução final
-
Vf= volume da solução final
⇒ Cálculo da molaridade ou concentração em mol/L:
A molaridade da solução final, após uma diluição, pode ser calculada pela seguinte expressão:
Mi.Vi = Mf.Vf
-
Mi= molaridade ou concentração em mol/L da solução inicial
-
Vi = volume da solução inicial
-
Mf = molaridade ou concentração em mol/L da solução final
-
Vf= volume da solução final
⇒ Cálculo do título em massa:
O título da solução final, após uma diluição, pode ser calculado pela seguinte expressão:
Ti.mi = Tf.mf
-
Ti= título da solução inicial
-
mi = massa da solução inicial
-
Tf = título da solução final
-
mf= massa da solução final
Como o título também pode ser calculado em forma de porcentagem e, em soluções aquosas, a massa tende a ter o mesmo valor do volume, podemos utilizar a seguinte expressão matemática:
Pi.Vi = Pf.Vf
-
Pi= porcentagem da solução inicial
-
Vi = volume da solução inicial
-
Pf = porcentagem da solução final
-
Vf= volume da solução final
Exemplos de cálculos realizados em diluição:
1º Exemplo - (UFBA) Acrescentando-se 300 mL de água a 100 mL de solução de bicarbonato de sódio a 8%, a concentração da solução obtida é:
a) 24% b) 18% c) 9% d) 4% e) 2%
Dados fornecidos pelo exercício:
-
Porcentagem da solução inicial (Pi) = 8%
-
Volume da solução inicial (Vi) = 100 mL
-
Volume da solução final (Vf) = 400 mL (resultado da mistura de 300 mL a 100 mL)
-
Porcentagem da solução final (Pf) = ?
Para calcular a concentração em porcentagem da solução, podemos utilizar esses valores fornecidos na seguinte expressão:
Pi.Vi = Pf.Vf
8.100 = Pf.400
800 = Pf.400
Pf = 800
400
Pf = 2%
2º Exemplo - (UFPA) 200 mL de uma solução de hidróxido de magnésio, Mg(OH)2, foram preparados dissolvendo-se 2,9 g da base em água. Qual o volume dessa solução que deve ser diluído para 300 mL de forma a se obter uma solução de molaridade igual a 0,125 M? Dados: H = 1; Mg = 24; O = 16.
a) 450 mL b) 150 mL c) 400 mL d) 300 mL e) 900 mL
Dados fornecidos pelo exercício:
-
Massa do soluto na solução inicial (m1) = 2,9 g
-
Volume da solução que será utilizada para a diluição = 200 mL ou 0,2 L (após dividir por 1000)
-
Volume da solução inicial (Vi) que será diluída = ?
-
Volume da solução final (Vf) = 300mL
-
Molaridade ou concentração em mol/L da solução final (Mf) = 0,125M
Para calcular a concentração em porcentagem da solução, devemos fazer o seguinte:
Passo 1: Calcular a massa molar do soluto.
Para isso, devemos multiplicar a quantidade de átomos de cada elemento pela sua respectiva massa atômica e, em seguida, somar os resultados:
MMg(OH)2 = 1.24 + 2.16 + 2.1
MMg(OH)2 = 24 + 32 + 2
MMg(OH)2 = 58 g/mol
Passo 2: Calcular a concentração em mol/L ou molaridade da solução inicial:
Mi = m1
M.V
Mi = 2,9
58.0,2
Mi = 2,9
11,6
Mi = 0,25 mol/L
Passo 3: Determinar o volume da solução que será diluída utilizando os valores fornecidos e encontrados na expressão a seguir:
Mi.Vi = Mf.Vf
0,25.Vi = 0,125.300
0,25.Vi = 37,5
Vi = 37,5
0,25
Vi = 150 mL
3º Exemplo – (UEG-GO) Considere que a 100 mL de uma solução aquosa de sulfato de cobre, com uma concentração igual a 40 g.L–1, foram adicionados 400 mL de água destilada. Nesse caso, cada mL da nova solução apresentará uma massa, em mg, igual a:
a) 2 b) 4 c) 8 d) 10
Dados fornecidos pelo exercício:
-
Volume de água adicionado à diluição = 400 mL
-
Volume da solução inicial (Vi) = 100 mL
-
Volume da solução final (Vf) = 500 mL (resultado da mistura de 400 mL a 100 mL)
-
Concentração comum da solução inicial (Ci) = 40 g.L–1
-
Concentração comum da solução final (Cf) em mg/mL= ?
Para calcular a concentração da solução em mg/mL, devemos fazer o seguinte:
Passo 1: Transformar a concentração da solução inicial de g/L para mg/mL.
Para isso, devemos multiplicar tanto o numerador quanto o denominador por 1000 e apenas dividir a concentração fornecida por 1000:
Ci = 40g .1000
1L . 1000
Ci = 40 mg/mL
Portanto, as unidades g/L e mg/mL são iguais.
Passo 2: Calcular a concentração em mg/mL utilizando os valores fornecidos na expressão a seguir:
Ci.Vi = Cf.Vf
40.100 = Cf.500
4000 = Cf.500
Cf = 4000
500
Cf = 8 mg/mL
Por Me. Diogo Lopes Dias

