Alotropia é um fenômeno que ocorre quando um mesmo elemento químico tem a propriedade de formar mais de uma substância simples. Essas variedades alotrópicas podem se diferir devido ao número de átomos do elemento que estão ligados numa molécula ou devido ao arranjo dos átomos no retículo cristalino.
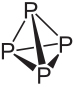
Um dos elementos que possuem variedades alotrópicas é o fósforo (P), sendo que as mais comuns são o fósforo branco e o fósforo vermelho. Esses dois alótropos do fósforo se diferem não pelo arranjo espacial diferente, pois ambos são constituídos basicamente de moléculas tetraédricas, porém a quantidade de átomos do fósforo é diferente em cada uma.
Veja a constituição e as principais características do fósforo branco e do vermelho:
- Fósforo branco:
A fórmula molecular do fósforo branco é P4, o que significa que suas moléculas são formadas por quatro átomos de fósforo.

Esse tipo de fósforo é extremamente reativo, em grande parte devido à tensão dos ângulos de 60º entre suas ligações. Ele é tão reativo que precisa ser guardado na água para não entrar em contato com o ar e explodir. Deve-se ter muito cuidado ao manipulá-lo, pois ele causa queimaduras graves na pele e intoxicação caso seja ingerido (apenas 0,1 g de fósforo branco ingerido pode levar à morte).
Como se pode ver abaixo, o fósforo branco é um sólido branco parecido com uma cera.

Fósforo branco guardado em água para não entrar em contato com o ar*
Se for aquecido na ausência de ar, o fósforo branco se transforma no fósforo vermelho.
- Fósforo vermelho:
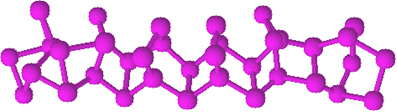
O fósforo vermelho não apresenta estrutura determinada, mas existem evidências de que ele se trata de macromoléculas formadas pela ligação das estruturas tetraédricas mencionadas (P4), sendo representadas por Pn.
Ele é bem menos reativo que o fósforo branco, porém, pode entrar em combustão se sofrer fricção. É por isso que ele é usado nas superfícies laterais das caixas de fósforo. Quando esfregamos o palito na superfície da caixinha, o fósforo se acende e, por sua vez, acende o material altamente inflamável que fica na cabeça do palito.
Em alguns países é colocado o fósforo na cabeça do palito na forma de P4S3.
O fósforo vermelho é um pó amorfo, isto é, que não possui estrutura cristalina, e de cor vermelho-escura, como mostrado abaixo:

Fósforo vermelho em pó.
Créditos da imagem: W. Oelen
Por Jennifer Fogaça
Graduada em Química

