O estanho, de símbolo Sn, é um metal de número atômico 50, pertencente ao Grupo 14 da Tabela Periódica. Esse metal está intimamente ligado à história do desenvolvimento de diversas sociedades, já que, associado ao cobre, forma o bronze, liga metálica bastante explorada durante a chamada Era do Bronze, por volta do ano 3500 a.C. O estanho também é muito utilizado na fabricação de latas para o acondicionamento de alimentos.
O estanho é considerado por alguns autores como um metal pesado, e alguns de seus compostos possuem certa toxicidade. Além dos usos já citados, o estanho é empregado na fabricação de folhas de flandres, soldas, outras ligas metálicas, como o peltre, produtos químicos em geral e outras aplicações de menor importância. Usos mais modernos, como fabricação de painéis de celulares, computadores e televisores, sensíveis ao toque, têm ajudado no aumento da demanda por estanho.
Leia também: Cobalto — metal presente na vitamina B12
Tópicos deste artigo
- 1 - Resumo sobre estanho
- 2 - Propriedades do estanho
- 3 - Características do estanho
- 4 - Para que serve o estanho?
- 5 - Obtenção do estanho
- 6 - Riscos do estanho
- 7 - História do estanho
- 8 - Exercícios resolvidos sobre o estanho
Resumo sobre estanho
-
O estanho é um metal polimórfico, ou seja, apresenta diversas estruturas cristalinas.
-
Tem baixo ponto de fusão, o que lhe permite ser muito utilizado na fabricação de ligas metálicas.
-
É resistente à corrosão.
-
Na sua forma metálica, não é tóxico para seres humanos.
-
É utilizado na fabricação do bronze e de diversas outras ligas.
-
É utilizado na fabricação de latas de alimentos e soldas.
Propriedades do estanho
-
Símbolo: Sn
-
Número atômico: 50
-
Massa atômica: 118,71 u.m.a
-
Eletronegatividade: 1,96
-
Configuração eletrônica: 4d105s25p2
-
Ponto de fusão: 232 °C
-
Ponto de ebulição: 2260 °C
-
Série química: metal; Grupo 14.
Características do estanho

O estanho possui três formas alotrópicas, o estanho cinza (ɑ-Sn), o estanho branco (β-Sn) e o estanho frágil (γ-Sn), sendo o estanho branco considerado a forma normal e a mais estável em temperatura ambiente. Entretanto, abaixo de 13,2 °C, a forma alotrópica branca se converte lentamente para a forma cinza, mais termodinamicamente estável nessas condições.
Essa alteração traz algumas mudanças estruturais para o estanho, pois o β-Sn possui uma densidade maior, de 7,31 g.cm-3, enquanto a forma ɑ-Sn possui uma densidade de 5,75 g.cm-3, contrariando o senso comum de que uma forma que ocorre em menor temperatura tenha, na verdade, maior densidade.
Isso se dá porque o estanho branco apresenta uma estrutura cristalina (arranjo dos átomos de estanho) mais compacta que a estrutura cristalina do estanho cinza. A estrutura cristalina do estanho cinza, inclusive, é a mesma do diamante, um alótropo do carbono, elemento da mesma família do estanho.
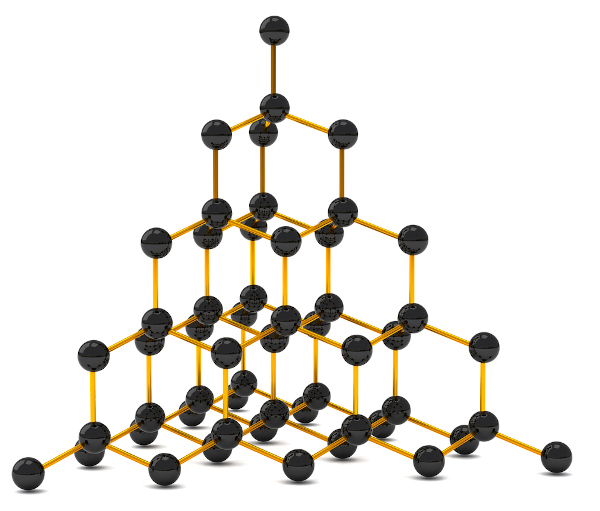
Em temperaturas acima de 161 °C, o alótropo γ-Sn é o que ocorre, permanecendo até a fusão do estanho, em 232 °C. Essas alterações estruturais dos alótropos do estanho fazem com que ele seja classificado como um metal polimórfico.
O estanho é também o elemento que mais possui isótopos estáveis, sendo 10 isótopos ao todo: 112Sn, 114Sn, 115Sn, 116Sn, 117Sn, 118Sn, 119Sn, 120Sn, 122Sn, 124Sn. O isótopo 120 é o com maior abundância, cuja ocorrência é de cerca de 33%.
O estanho (branco) se apresenta como um metal brilhoso, branco acinzentado, insolúvel em água e pouco reativo em temperatura ambiente, sendo inerte ao oxigênio, nitrogênio, hidrogênio e amônia. Contudo, o estanho é bastante reativo com halogênios.
A oxidação do estanho ocorre apenas em sua superfície e em altas temperaturas (acima de 200 °C). O estado de oxidação mais provável para o estanho é o +4, enquanto o estado +2 é mais escasso. Há ainda citações de estados +3 e +1, mas são muito raros.
-
Videoaula sobre os metais
Para que serve o estanho?
O estanho tem seu uso clássico na fabricação do bronze, uma liga que esse metal faz com o cobre. Contudo, o estanho também foi amplamente utilizado na confecção de latas de alimentos, nas quais a estrutura de aço é recoberta por um filme de estanho, garantindo que a estrutura de aço não seja comprometida por reações de oxidação.

O estanho também é utilizado na fabricação das chamadas folhas de flandres, um revestimento utilizado em folhas de aço na proporção de quatro quilos de estanho para cada tonelada de aço. Esse revestimento torna o aço mais resistente à corrosão.
Além do bronze, outra liga metálica amplamente utilizada que possui estanho na composição é o peltre (ou pewter). Nessa liga, o teor de estanho varia de 85% a 99%, sendo misturado ao cobre, antimônio, bismuto e, às vezes, ao chumbo.

Outra utilização do estanho é em soldas. Isso porque o estanho possui um baixo ponto de fusão e uma boa tendência em formar ligas com outros metais, algo que aumenta a demanda do metal, já que é utilizado na soldagem de dispositivos eletrônicos.
A utilização do estanho vem se tornando cada vez mais diversa também. Hoje é possível utilizar o metal na fabricação de tintas anti-incrustantes, como catalisador, na fabricação de painéis de celulares, computadores e televisores sensíveis ao toque. Os compostos conhecidos como organoestânicos são também agentes biocidas, ou seja, atuam como antimicrobianos, antitumorais, antifúngicos, antimaláricos e anti-inflamatórios.
Confira no nosso podcast: Duro como diamante: o que significa?
Obtenção do estanho
-
Fontes minerais de estanho
Mesmo sendo considerado um elemento bem distribuído pelo planeta (alguns o consideram até onipresente), o estanho é um dos elementos de menor abundância da crosta terrestre. Ocorre principalmente na forma dos minerais cassiterita (SnO2) e na forma de minerais sulfetados, como o caso da estanita e tealita.

-
Onde o estanho é encontrado?
Boa parte do estanho do mundo se distribui entre o oeste africano, o sudeste asiático, Austrália, Bolívia, Brasil, Indonésia e Rússia. A China, atualmente, é a maior produtora do estanho do mundo.
O Brasil entrou no cenário internacional de comércio do estanho após as descobertas das maiores jazidas nacionais no Amazonas (Pitinga) e em Rondônia (Bom Futuro), na década de 1980. Dados do Anuário Mineral Brasileiro de 2020 apontam que o Brasil apresentou uma produção beneficiada de minério de estanho de cerca de 24,6 mil toneladas, além de lucrar cerca de 195 milhões de dólares com exportação dessa substância metálica.
Riscos do estanho
Na sua forma metálica, o estanho não apresenta riscos à saúde humana. Contudo, os compostos organoestânicos, citados anteriormente como bons agentes biocidas, necessitam de manuseio adequado, pois relata-se aspectos prejudiciais, tais como efeitos citotóxicos, genotóxicos, mutagênios e neurotóxicos. O cloreto de tributil estanho, (C4H9)3SnCl ou TBTC (sua sigla em inglês), utilizado como aditivo para o polímero PVC, está ligado a múltiplos efeitos de desregulação endócrina.
Altos níveis de exposição aos compostos inorgânicos de estanho podem causar erupções cutâneas, problemas estomacais, náusea, vômitos, diarreia, dores abdominais, dores de cabeça e palpitações. Já a exposição a baixos níveis de compostos inorgânicos de estanho pode resultar em fadiga, depressão, falta de ar, problemas do coração, asma e insônia.
História do estanho
O ser humano sempre se diferenciou das demais espécies por conta da sua capacidade de criar ferramentas e instrumentos. Foi assim com pedras, madeira e ossadas de animais, até a descoberta do cobre, por volta de 9000 a.C. Esse metal se destacou por ter grande abundância, fácil fusão e ser facilmente moldado.
Até que, por volta do ano de 3500 a.C., descobriu-se que o cobre, ao ser combinado com estanho, poderia se tornar mais duro e forte, dando origem ao bronze. Apesar de o estanho ser manipulado há bastante tempo, de modo que a data certa de sua descoberta tenha se perdido ao longo da história da humanidade, raras são as peças de estanho puras que remontam à Antiguidade. Com isso, pesquisadores acreditam que a obtenção do bronze é provavelmente anterior à metalurgia do estanho.
Uma folha pura de estanho foi descoberta em um sarcófago de um contemporâneo de Tutemóses III, faraó entre 1479 e 1435 a.C. O estanho também é citado em livros do Velho Testamento (Números, Ezequiel, Isaias e Zacarias) e mencionado na obra Ilíada, na qual Homero se refere ao estanho como cassíteros, o que leva a crer que talvez o estanho fosse um metal estratégico e precioso em tempos antigos.
As primeiras fontes de estanho são incertas. Heródoto, por volta de 440 a.C., refere-se à ilha de Cassitérides como a fonte de estanho para o bronze grego. A localização atual dessa ilha foi alvo de muitos debates, sendo identificada com diversos locais, como a Cornualha, a costa norte francesa, os Açores ou ainda as ilhas Sorlingas. Apenas em 8 a.C., a Cornualha foi identificada como fonte de estanho, por meio da obra de Diodorus Siculus, Bibliotheca historica.
Os alquimistas gregos chamavam o estanho de Hermes, porém, a partir de cerca de 500 a.C., começaram a chamá-lo de Zeus ou Júpiter, utilizando um símbolo que era a junção da primeira e última letras da palavra Zευζ, a qual significa Zeus em grego.
Embora muitos trabalhos tenham descrito propriedades do estanho e suas ligas, como Geber (721 a 815 d.C.), em Summa Perfectionis Magisterii, e os estudos de Libavius, no século XVII, apenas no século XVIII é que os compostos inorgânicos de estanho começaram a ser amplamente estudados.
Em 1849, Sir Edward Frankland preparou o primeiro composto organoestânico, o SnEt2I2 (Et significa etil). Tal descoberta, junto à descoberta dos reagentes de Grignard, desencadeou um aumento no número de compostos orgânicos e inorgânicos de estanho.
Há uma história curiosa acerca do estanho. Diz-se que Napoleão Bonaparte, em uma campanha pela Rússia, diante de problemas com seu exército, decidiu rumar direto para Moscou, porém, com a resistência russa, desencadeou-se a Batalha de Borodino, na qual muitos soldados franceses morreram, permitindo a reconstituição do exército russo.
Napoleão enfim conseguiu ocupar Moscou, mas, quando retirou seu exército da região, já era inverno. Sendo assim, os militares se viram obrigados a voltar em temperaturas da faixa de -40 °C. Nessas condições, aventou-se a hipótese de que os botões dos soldados seriam de estanho, e, nas condições do inverno russo, tal metal sofreria uma transição alotrópica (β-Sn para ɑ-Sn), além de oxidação, tornando-se quebradiço.
Com isso, os soldados franceses não conseguiriam manter as roupas fechadas para se protegerem do frio e utilizarem as armas ao mesmo tempo, ocasionando diversas baixas no exército francês e fazendo com que apenas 1/6 do contingente retornasse.

Apesar de interessante, a história narrada no livro Os botões de Napoleão: as 17 moléculas que mudaram a história, de Jay Burreson, parece não se sustentar, uma vez que já se comprovou que os botões dos franceses eram de bronze, ou seja, cobre com estanho, e não apenas estanho.
Exercícios resolvidos sobre o estanho
Questão 1
(ESPCEX) Baseado no texto a seguir responda.
“... Por mais surpreendente que pareça, a desintegração do exército napoleônico pode ser atribuída a algo tão pequeno quanto um botão — um botão de estanho, para sermos mais exatos, do tipo que fechava todas as roupas no exército, dos sobretudos dos oficiais às calças e paletós dos soldados de infantaria.
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico — continua sendo estanho, mas com forma estrutural diferente.” (Adaptado de Os Botões de Napoleão – Penny Le Couteur e Jay Burreson – Pag 8).
O texto acima faz alusão a uma reação química, cujo produto é um pó acinzentado e não metálico. A alternativa que apresenta corretamente o nome e fórmula química dessa substância é:
(A) cloreto de estanho de fórmula SnCl2.
(B) estanho metálico de fórmula Sn.
(C) óxido de estanho VI de fórmula Sn2O3.
(D) peróxido de estanho de fórmula Sn3O2.
(E) óxido de estanho II de fórmula SnO.
Resolução:
Letra E. O exercício deixa claro que o que ocorre é a transformação do estanho metálico por conta da exposição ao oxigênio do ar, formando um pó acinzentado e não metálico. Por ser não metálico, entende-se que estamos falando de um óxido, afinal, o estanho está em contato com o oxigênio.
O único óxido possível para o estanho e de fórmula correta entre as alternativas é o da letra E, pois o estanho comumente se apresenta com NOx +2 ou +4.
Questão 2
(Enem) Alimentos em conserva são frequentemente armazenados em latas metálicas seladas, fabricadas com um material chamado folha de flandres, que consiste de uma chapa de aço revestida com uma fina camada de estanho, metal brilhante e de difícil oxidação. É comum que a superfície interna seja ainda revestida por uma camada de verniz à base de epóxi, embora também existam latas sem esse revestimento, apresentando uma camada de estanho mais espessa.
SANTANA. V. M. S. A leitura e a química das substâncias. Cadernos PDE Ivaiporã Secretaria de Estado da Educação do Paraná (SEED); Universidade Estadual de Londrina, 2010 (adaptado).
Comprar uma lata de conserva amassada no supermercado é desaconselhável porque o amassado pode
(A) alterar a pressão no interior da lata, promovendo a degradação acelerada do alimento.
(B) romper a camada de estanho, permitindo a corrosão do ferro e alterações do alimento.
(C) prejudicar o apelo visual da embalagem, apesar de não afetar as propriedades do alimento.
(D) romper a camada de verniz, fazendo com que o metal tóxico estanho contamine o alimento.
(E) desprender camadas de verniz, que se dissolverão no meio aquoso, contaminando o alimento.
Resolução
Letra B. As folhas de flandres, como o enunciado diz, são uma fina camada de estanho utilizada para revestir o aço das latas metálicas de alimentos, uma vez que o estanho é de difícil oxidação. Contudo, quando se amassa a lata, essa fina camada de estanho pode se romper, o que permitiria a corrosão do ferro, metal esse pouco resistente à oxidação, causando alterações no alimento.
Apesar da presença do verniz à base de epóxi, o estanho na sua forma metálica é atóxico, não causando danos à saúde humana, tanto que existem latas sem esse revestimento de verniz. Sendo assim, a resposta é a da letra B.
Por Stéfano Araújo Novais
Professor de Química

