O clorofórmio é uma substância orgânica clorada com fórmula química CHCl3. Em temperatura ambiente, se apresenta na forma líquida, sendo denso, incolor, com odor característico e bastante volátil.
Possui como principais aplicações atuar como solvente e reagente químico. Faz parte da produção do gás refrigerante Freon R-22, é usado na indústria farmacêutica, na fabricação de corantes e de fertilizantes.
Logo após a sua descoberta, em torno de 1800, passou a ser usado como anestésico em procedimentos médicos. Esse uso acabou sendo abandonado algumas décadas depois, em razão dos riscos de parada cardíaca nos pacientes e efeitos tóxicos.
A exposição ao clorofórmio afeta os sistemas renal e hepático, favorecendo o desenvolvimento de doenças e possivelmente de câncer.
Leia também: Benzeno — estrutura tóxica muito utilizada em laboratórios
Tópicos deste artigo
- 1 - Resumo sobre clorofórmio
- 2 - Propriedades do clorofórmio
- 3 - Características do clorofórmio
- 4 - Estrutura do clorofórmio
- 5 - Para que serve o clorofórmio?
- 6 - Obtenção do clorofórmio
- 7 - Ocorrência do clorofórmio
- 8 - Precauções com o clorofórmio
- 9 - Clorofórmio e as drogas
- 10 - História do clorofórmio
- 11 - Curiosidades sobre o clorofórmio
Resumo sobre clorofórmio
-
O clorofórmio é um composto orgânico clorado, com fórmula CHCl3.
-
É líquido em temperatura ambiente.
Não pare agora... Tem mais depois da publicidade ;) -
É incolor, com odor característico e altamente volátil.
-
É usado como solvente e reagente químico.
-
Na indústria participa da fabricação do Freon R-22, da extração de princípios ativos farmacêuticos, da produção de fertilizantes etc.
-
Logo após a sua descoberta, foi usado como anestésico.
-
É tóxico aos seres vivos, causando sensação de torpor, desmaios e afetando o sistema hepático e renal.
-
É produzido de forma natural por meio da cloração de matéria orgânica.
Não pare agora... Tem mais depois da publicidade ;)
Propriedades do clorofórmio
-
Fórmula: CHCl3.
-
Massa molar: 119,37 g/mol.
-
Estado físico: líquido (20 °C).
-
Densidade: 1,49 g/cm3 (25 °C).
-
Ponto de fusão: -63,5 °C.
-
Ponto de ebulição: 61,2 °C.
Não pare agora... Tem mais depois da publicidade ;) -
Solubilidade em água: 8,09 g/L (20 °C).
-
Pressão de vapor: 25,9 kPa (25 °C).
-
Acidez: 15,7 (20 °C).
-
Momento de dipolo: 1,15 D.
Características do clorofórmio
Clorofórmio é o nome comum para o composto orgânico triclorometano, que possui fórmula molecular CHCl3. Em temperatura ambiente, o clorofórmio é um líquido denso e incolor, altamente volátil e não inflamável. Possui odor forte e característico, muito semelhante ao éter.
Por ser um composto orgânico, o clorofórmio é miscível em outros solventes de mesma natureza, como em benzeno, álcool, tetracloreto de carbono e éter. Em água, é muito pouco solúvel.
O clorofórmio líquido possui poder corrosivo sobre alguns plásticos, borrachas e revestimentos.
Estrutura do clorofórmio
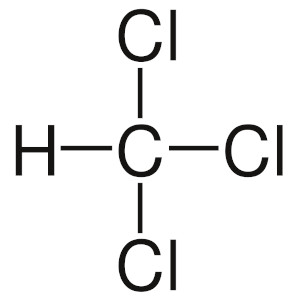
A molécula do clorofórmio é formada por um átomo central de carbono unido a três átomos de cloro e um único átomo de hidrogênio, organizados em uma estrutura tetraédrica.
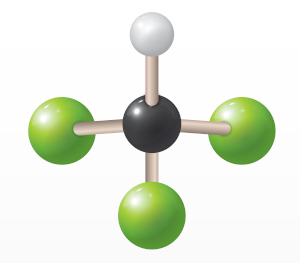
Como o cloro é um elemento bastante eletronegativo, essa molécula é considerada polar, com momento de dipolo de 1,15 D.
Para que serve o clorofórmio?

Atualmente, um dos principais usos do clorofórmio é na produção do gás refrigerante Freon R-22. Essa substância pertence à classe dos hidroclorofluorocarbonos e é empregada em equipamentos de ar-condicionado residenciais e industriais.
Contudo, em razão da vigência do Protocolo de Montreal, a tendência é de redução do consumo de clorofórmio para esse fim, pois o R-22 vem sendo substituído por outros agentes refrigerantes de menor impacto ambiental.
Como solvente orgânico, o clorofórmio é empregado na indústria farmacêutica para a extração de alguns princípios ativos, como alcaloides. Também encontra uso na fabricação de pesticidas e corantes. Na área de pesquisa, o clorofórmio contendo deutério (isótopo do hidrogênio) é usado como solvente para análises de Ressonância Magnética Nuclear (RMN).
Como reagente químico, o clorofórmio faz parte de processos químicos específicos para a obtenção de diferentes produtos orgânicos contendo o grupo -CCl2.
Antigamente, em meados de 1800, o clorofórmio foi muito usado como anestésico. A inalação de vapores dessa substância é capaz de diminuir a ação do sistema nervoso central, causando tontura e inconsciência, o que permitiu que os médicos da época efetuassem procedimentos médicos sem sofrimento ao paciente.
Leia também: Etoxietano — outra substância que foi muito utilizada como anestésico
Obtenção do clorofórmio
Em nível industrial, o clorofórmio é produzido pelo aquecimento de uma mistura entre cloro (Cl2) e clorometano (CH3Cl) ou metano (CH4). Em temperatura entre 400 °C a 500 °C, ocorre a halogenação de radicais livres, convertendo o metano ou o clorometano em compostos progressivamente com maior quantidade de átomos de cloro.
\(CH_4+ Cl_2 ⟶\color{blue}{CH_3}\color{red}{Cl}+HCl \)
\(\color{blue}{CH_3}\color{red}{Cl}+Cl_2 ⟶ \color{blue}{CH_2}\color{red}{Cl_2}+HCl\)
\(\color{blue}{CH_2}\color{red}{Cl_2}+ Cl_2 ⟶ \color{blue}{CH}\color{red}{Cl_3}+HCl\)
A continuação desse processo dá origem ao tetracloreto de carbono (CCl4). Ao final do processo, o produto é uma mistura desses quatro compostos orgânicos clorados, que são adequadamente separados por meio de destilação.
Em pequenas escalas, o clorofórmio pode ser produzido pela reação entre acetona e hipoclorito de sódio, em uma reação denominada “reação de halofórmio”:
\(3\ NaClO+(CH_3)_2\ CO ⟶\color{red}{CHCl_3}+2\ NaOH+ CH_3 COONa\)
Ocorrência do clorofórmio
Apesar de o clorofórmio ser um produto com alta demanda industrial e, por isso, produzido em larga escala, cerca de 90% das emissões de clorofórmio são de origem natural.
Diversos tipos de algas marinhas são organismos produtores de clorofórmio. Acredita-se que no solo existam alguns tipos de fungos que produzem esse composto orgânico.
O clorofórmio é produzido em decorrência da interação entre o cloro e substâncias orgânicas, por isso pode ocorrer em águas naturais e até mesmo na água potável (que geralmente recebe tratamento com cloro). Há legislação em cada país que regula os níveis aceitáveis dessa substância na água de abastecimento. No Brasil, a água potável pode conter até 0,1 mg/L de clorofórmio (valor máximo permitido).
Em razão da alta volatilidade, o clorofórmio gerado por esses microrganismos é rapidamente dissipado no ar, sofrendo degradação e se transformando em diferentes compostos, tais como fosgênio, diclorometano, monóxido de carbono, dióxido de carbono e ácido clorídrico. Após emitido para a atmosfera, o clorofórmio pode ficar no ar de 55 a 602 dias.
O clorofórmio não é uma substância que passa por bioacumulação nos organismos vivos aquáticos.
Precauções com o clorofórmio
O clorofórmio é uma substância naturalmente presente no meio ambiente em baixas concentrações.
O principal efeito da exposição aguda (em curto prazo) é a depressão do sistema nervoso central. A exposição crônica (tempo prolongado) por meio de inalação causa efeitos danosos ao fígado, com o desenvolvimento de hepatite e icterícia, aos rins e ao sangue, além dos efeitos sobre o sistema nervoso central, como irritabilidade e depressão.
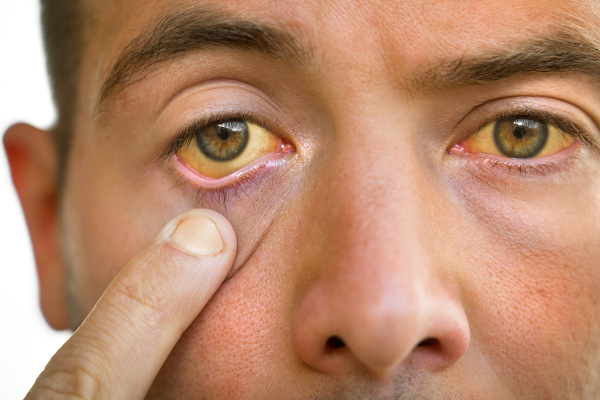
Testes de laboratório em animais demonstraram que a administração oral de doses de clorofórmio resultou em efeito carcinogênico, atuando sobre os sistemas renal e hepático. A Agência de Proteção Ambiental dos Estados Unidos classifica o clorofórmio como provável cancerígeno humano.
Clorofórmio pode ser liberado à atmosfera durante a cloração da água potável e no tratamento de piscinas. Indústrias de papel e celulose, locais de resíduos perigosos e aterros sanitários são locais de possível contaminação atmosférica.
Estima-se que a dose oral fatal de clorofórmio em humanos pode ser menor do que 10 mL, com morte causada por parada cardíaca ou problemas respiratórios.
Clorofórmio e as drogas
O clorofórmio, em razão de sua capacidade anestesiante, é um agente químico utilizado em entorpecentes, como o loló e o lança-perfume.
O loló ou “cheirinho da loló” é uma droga que se popularizou em festas na Inglaterra no século XIX, em que as pessoas aspiravam o vapor de clorofórmio de forma direta ou molhavam um tecido com a substância, procedendo à inalação ou contato com a mucosa da boca. O efeito era uma sensação de torpor, redução dos reflexos e confusão mental.
O lança-perfume é derivado do loló e é uma mistura entre clorofórmio e éter, com outras substâncias que fornecem um aroma adocicado à mistura resultante, gerando efeitos semelhantes aos descritos para o loló. Essa substância se tornou popular nos blocos de carnaval do Rio de Janeiro a partir de 1906, sendo trazida da Argentina. Inicialmente, o uso e a venda eram livres e inocentes, pois a intenção era animar e deixar o ambiente perfumado.

Hoje em dia se conhecem os efeitos do loló e do lança-perfume em causar dependência física, psicológica e danos irreversíveis à saúde, sendo ambos tratados como entorpecentes viciantes e nacionalmente proibidos.
Leia também: Nicotina — o alcaloide presente em cigarros que causa dependência química
História do clorofórmio
O clorofórmio foi descoberto de forma independente em 1831 pelo americano Samuel Guthrie e pelos químicos franceses Eugène Soubeiran e Justus von Liebig na Alemanha.
Os cientistas usaram variações da reação do halofórmio para chegarem ao clorofórmio. O nome “clorofórmio” apenas foi atribuído à substância em 1834, por Jean-Baptiste Dumas.
Em 1847, a substância foi usada pela primeira vez como anestésico geral durante um parto. Após esse fato, o uso do clorofórmio com essa aplicação se popularizou entre os profissionais de saúde da Europa.
No entanto, foi percebida sua toxicidade e riscos aos pacientes, pois arritmia cardíaca fatal ocorreu em diversas ocasiões. Então, foi substituído pelo éter no início do século XX.
Curiosidades sobre o clorofórmio
-
O clorofórmio foi usado como anestésico entre 1847 e a primeira metade do século XX, até que se percebessem seus efeitos tóxicos.
Não pare agora... Tem mais depois da publicidade ;) -
Foi usado no parto do oitavo filho da Rainha Vitória, importante membro da família real britânica.
-
O fluxo global total de clorofórmio no meio ambiente é de cerca de 660 mil toneladas por ano.
-
O clorofórmio é um produto usado por criminosos a fim de atordoar vítimas, facilitando a ocorrência de crimes.
-
É o principal componente de drogas entorpecentes conhecidas como loló e lança-perfume, as quais são comuns entre pessoas mais jovens.
Por Ana Luiza Lorenzen Lima
Professora de Química
