Os gases são fluidos que, diferentemente dos líquidos, ocupam todo o espaço disponível do recipiente onde estão confinados. As moléculas que compõem os gases apresentam livre movimentação e interagem entre si e com as paredes do recipiente.
O gás perfeito ou ideal é um gás idealizado, apresenta características particulares e obedece à lei geral dos gases e à equação de Clapeyron.
Características dos gases perfeitos
-
Não há interação gravitacional entre as moléculas;
-
As colisões entre as moléculas são perfeitamente elásticas, ou seja, há total conservação da energia cinética;
-
As moléculas apresentam movimento desordenado e velocidades que dependem diretamente do valor da temperatura do gás;
-
O volume próprio de cada molécula é completamente insignificante quando comparado com o volume total do gás.
Não pare agora... Tem mais depois da publicidade ;)
Variáveis de estado
Pressão, temperatura e volume são as grandezas físicas escalares que caracterizam um gás. Essas grandezas são chamadas de variáveis de estado e mantêm entre si relações de proporcionalidade.
A lei de Boyle determina que a relação entre a pressão e o volume de um gás é inversamente proporcional. Quanto maior for a pressão sobre as moléculas, menor será o espaço ocupado por elas.
A lei de Gay-Lussac determina que a relação entre o volume e a temperatura de um gás é diretamente proporcional. Quanto maior for a temperatura de um gás, maior será a agitação das moléculas, que tenderão ao afastamento, aumentando o espaço ocupado por elas.
A lei de Charles determina que a relação entre a pressão e a temperatura de um gás é diretamente proporcional. Quanto maior for a temperatura de um gás, maior será a agitação molecular. Assim, a incidência de colisões entre as moléculas e as paredes do recipiente aumenta, tornando a pressão do gás maior.
A equação de Clapeyron sintetiza as três leis anteriormente apresentadas e determina uma única relação entre as variáveis de estado.
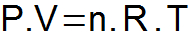
P = pressão do gás (atm ou N/m2);
V = volume do gás (L ou m3);
n = número de mols;
R = constante universal dos gases (0,082 atm.l/mol.K ou 8,31 J/mol.K);
T = temperatura do gás (K).
Gás ideal na natureza
A natureza não produz gases que apresentem as caraterísticas de um gás perfeito. O gás ideal é um modelo teórico e útil para a compreensão do comportamento dos gases diante das alterações provocadas em suas características.
Por Joab Silas
Graduado em Física
