Gás ideal é aquele em que as colisões entre as partículas são perfeitamente elásticas. Entre as partículas dele, não há qualquer tipo de interação, como forças atrativas ou repulsivas, além disso, essas partículas não ocupam espaço.
De acordo com a teoria cinética dos gases, o estado termodinâmico de um gás ideal é completamente descrito pelas variáveis de pressão, volume e temperatura.
Veja também: Calorimetria: mapa mental, fórmulas e exercícios resolvidos
Tópicos deste artigo
- 1 - Conceito de gás ideal
- 2 - Características dos gases ideais
- 3 - Lei dos gases ideais
- 4 - Energia interna do gás ideal
- 5 - Exercícios resolvidos sobre gases ideais
Conceito de gás ideal
Os gases ideais são compostos exclusivamente por partículas de dimensões puntuais (de tamanho desprezível) que se encontram em movimento caótico e em alta velocidade. Nesse tipo de gás, a temperatura e a velocidade de translação das partículas são proporcionais.
Uma vez que não há interação entre as partículas de um gás ideal, a energia interna desse gás é sempre igual à soma da energia cinética de todas as partículas que o constituem.
Quaisquer que sejam os gases ideais, eles sempre contarão com o mesmo número de partículas para o mesmo volume. A massa deles, por sua vez, dependerá diretamente da sua massa molar (medida em g/mol), além disso, 1 mol de gás ideal (cerca de 6,0.1023 partículas) sempre ocupará um volume igual a 22,4 l.
Os gases reais, em que há ocorrência de colisões inelásticas entre partículas, aproximam-se muito do comportamento dos gases ideais em regimes de baixas pressões e altas temperaturas. Por coincidência, nas condições normais de pressão e temperatura da Terra (25 ºC e 1 atm), a maior parte dos gases comporta-se como gases ideais, e isso facilita o cálculo de previsões acerca do comportamento termodinâmico deles.
Alguns gases, como o vapor d'água, que se encontra diluído no gás atmosférico, não podem ser considerados gases ideais mas sim gases reais. Esses gases apresentam interações significativas entre suas partículas, que podem condensar-se, fazendo com que eles liquefaçam-se, caso haja uma queda de temperatura.
Características dos gases ideais
Confira, em resumo, algumas características dos gases ideais:
- Neles só ocorrem colisões perfeitamente elásticas entre partículas;
- Neles não existem interações entre partículas;
- Neles as partículas têm dimensões desprezíveis;
- 1 mol de gás ideal ocupa um volume de 22,4 l, independentemente de qual seja o gás;
- Gases reais comportam-se como gases ideais quando em regimes de baixas pressões e altas temperaturas;
- Grande parte dos gases comporta-se de forma similar aos gases ideais.
Lei dos gases ideais
O estudo dos gases desenvolvido pelos estudiosos Charles Boyle, Joseph Louis Gay-Lussac e Robert Boyle levaram ao surgimento de três leis empíricas, usadas para explicar o comportamento dos gases ideais em regimes de temperatura, pressão e volume constantes, respectivamente.
Juntas essas leis formaram a base necessária para o surgimento da lei dos gases ideais, que relaciona o estado termodinâmico inicial de um gás, definido pelas grandezas P1, T1 e V1, com o seu estado termodinâmico final (P2, V2 e T2), depois de ter sofrido alguma transformação gasosa.
Confira a fórmula da lei geral dos gases:
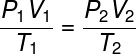
A lei geral dos gases afirma que o produto da pressão pelo volume do gás, divido pela temperatura termodinâmica, em kelvin, é igual a uma constante. Essa constante, por sua vez, é descrita pela equação de Clapeyron, observe:
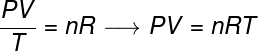
n – número de mols (mol)
R – constante universal dos gases perfeitos (0,082 atm.l/mol.K ou 8,31 J/mol.K)
Na fórmula, P é a pressão exercida pelo gás, V é o volume ocupado por esse gás, e T é a temperatura, medida em kelvin. A grandeza n refere-se ao número de mols, enquanto R é a constante universal dos gases ideais, que, frequentemente, é medida em unidades de atm.l/mol.K ou em J/mol.K, sendo essa última adotada pelo SI.
Veja também: O que é vento solar e como ele afeta a atmosfera terrestre?
Energia interna do gás ideal
A energia interna dos gases ideais pode ser calculada por meio do produto entre a constante de Boltzmann e a temperatura termodinâmica, observe:
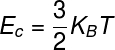
KB – constante de Boltzmann (KB = 1,38.10-23 J/K)
Da relação anterior, que nos permite calcular a energia cinética média das partículas de um gás ideal, tiramos a fórmula seguinte, que pode ser usada para calcular qual deve ser a velocidade quadrática média das moléculas de um gás ideal, para uma determinada temperatura T, observe:
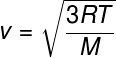
M – massa molar (g/mol)
Essa fórmula permite visualizar que um acréscimo na temperatura de um gás ideal resulta em um aumento na velocidade quadrática média das partículas.
Saiba mais: Descubra do que é formada a luz e quais são as suas características
Exercícios resolvidos sobre gases ideais
Questão 1) Dois mols de um gás ideal, e à pressão de 1 atm, encontram-se à temperatura de 227 ºC. Calcule, em litros, o volume ocupado por esse gás.
Dados: R = 0,082 atm.l/mol.K
a) 75 l
b) 82 l
c) 15 l
d) 27 l
e) 25 l
Gabarito: Letra b
Resolução:
Para calcularmos o volume desse gás, usaremos a equação de Clapeyron, porém, antes de fazermos o cálculo, é necessário transformar a temperatura de 227 ºC em kelvin. Para isso somamos a essa temperatura o fator 273, resultando em uma temperatura de 500 K.
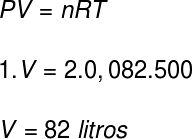
De acordo com a resolução, o volume ocupado pelo gás é de 82 litros.
Questão 2) Um gás ideal ocupa um volume de 20 l, quando passa a ser submetido a uma pressão de 3 atm, de modo que sua temperatura permanece constante, enquanto o seu volume é triplicado. Calcule a pressão final desse gás depois de ter passado por essa transformação.
a) 1 atm
b) 3 atm
c) 5 atm
d) 8 atm
e) 9 atm
Gabarito: Letra a
Resolução:
Para resolvermos esse exercício, utilizaremos a lei geral dos gases, observe:
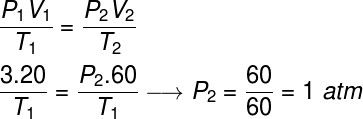
Para fazermos o cálculo, foi necessário atribuir um volume de 60 l ao gás, uma vez que seu volume triplicou durante a transformação.
Por Rafael Helerbrock
Professor de Física
