| A difusão de um gás é um movimento espontâneo de um gás através do outro, isto é, seu espalhamento em outro meio gasoso. |
Essa mistura de gases origina misturas homogêneas ou soluções gasosas. Por exemplo, os gases que saem das chaminés das fábricas, ou dos escapamentos dos carros, se espalham pelo ar atmosférico e, com o passar do tempo, não conseguimos distingui-los mais, pois houve uma difusão desses gases pelo ar.

Os gases lançados pelas chaminés difundem-se e “perdem-se” no ar atmosférico, porque o volume do ar é muito maior que o da fumaça.
| A efusão dos gases é um tipo particular de difusão, em que há o vazamento dos gases através de pequenos orifícios (ou paredes porosas, que é um conjunto de pequenos orifícios). |
Por exemplo, os balões vendidos para crianças são preenchidos com gás hélio. Com o passar do tempo, esse gás acaba passando pelos poros da borracha do balão, ou seja, há a sua efusão. Isso é constatado pelo fato de o balão murchar após algumas horas.
O químico escocês Thomas Graham, em 1829, estudou esse comportamento dos gases. Ele concluiu que a velocidade em que um gás se difundia ou efundia em outro está relacionada com a sua densidade. Como os seus dados experimentais se repetiam para todos os gases, ele criou a seguinte lei que leva seu nome:
Lei de Graham: a velocidade de difusão ou efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
Matematicamente, essa lei pode ser expressa pela equação:
v α 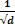
Ou, relacionando dois gases diferentes, temos:
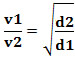
A unidade usada nesse caso é o “volume que escapa por unidade de tempo”; sendo, portanto, geralmente L/min (litros por minuto).
Assim, gases com menor densidade difundem-se mais rapidamente. Se estiver na mesma condição de temperatura e pressão, pode-se também fazer uma relação disso com a massa molar do gás: quanto maior a densidade do gás, maior será a sua massa molar e menor a sua velocidade de difusão; e vice-versa. Desse modo, temos:
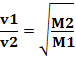
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola
