PUBLICIDADE
A molaridade ou concentração molar é uma unidade de concentração que expressa a quantidade de substância, em mol, dividida pelo volume da solução. Geralmente é representada por M e, de maneira geral, utiliza-se a unidade mol.L−1 para representar seus valores.
A molaridade, embora de grande utilidade na rotina dos químicos, não costuma ser utilizada no cotidiano, em que é mais comum expressar unidades de concentração na forma de concentração comum, g.L−1, ou em unidades percentuais.
Leia também: O que é a densidade das soluções?
Tópicos deste artigo
- 1 - Resumo sobre molaridade ou concentração molar
- 2 - O que é molaridade?
- 3 - Fórmula da molaridade
- 4 - Como calcular a molaridade?
- 5 - Uso da molaridade no cotidiano
- 6 - Qual a diferença entre molaridade e molalidade?
- 7 - Qual a diferença entre molaridade e concentração comum?
- 8 - Exercícios resolvidos sobre molaridade ou concentração molar
Resumo sobre molaridade ou concentração molar
- A molaridade ou concentração molar é uma unidade de concentração que expressa a quantidade de substância, em mol, dividida pelo volume da solução.
- É comumente representada pela unidade mol.L−1.
- Embora de grande utilidade para os químicos, a molaridade é pouco vista em produtos de uso cotidiano.
- É comum confundir molaridade com molalidade, sendo esta calculada como a quantidade de soluto, em mol, dividida pela massa da solução.
- Enquanto a molaridade é expressa em mol.L−1, a concentração comum é expressa em g.L−1 e semelhantes.
O que é molaridade?
A molaridade ou concentração molar é uma unidade de concentração definida como a quantidade da substância, em mol, dividida pelo volume da solução. É geralmente representada pela letra M, sendo utilizada a unidade mol.L−1 (ou mol/L) na maioria dos casos.
Quando queremos designar a concentração molar de uma substância de forma isolada, também é possível a utilização dos colchetes, [ ]. Por exemplo, se quero dizer que a concentração molar da substância A é de 2 mol.L−1, pode-se escrever que [A] = 2 mol.L−1.
Fórmula da molaridade
A molaridade, representada pela letra M, tem a seguinte fórmula:
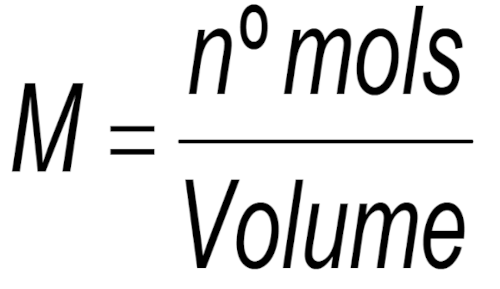
O numerador, número de mols (ou quantidade de matéria) da substância, não se altera e tem sempre a unidade mol. Contudo, para o denominador, qualquer unidade volumétrica é aceita. Ainda assim, é praticamente unânime a utilização de mol.L−1.
Como calcular a molaridade?
O cálculo da molaridade passa pela resolução direta da fórmula; porém, algumas questões, pode-se dificultar o cálculo, como quando:
- não se indica o número de mols da substância, mas sim sua massa;
- não se indica o número de mols da substância, mas sim o seu número de átomos, íons ou moléculas;
- se necessita converter a unidade volumétrica para o que o exercício exige.
Exemplo:
Estão dissolvidos em volume suficiente de água 8,0 gramas de hidróxido de sódio, NaOH, formando uma solução de 500 mL. Calcule a concentração molar (em mol.L−1).
Resolução:
Inicialmente, devemos converter a quantidade de massa de NaOH para quantidade de matéria (mols). Para isso, utiliza-se a massa molar da substância. Para o NaOH, a massa molar é de 40 g.mol−1, o que significa que cada mol de hidróxido de sódio tem uma massa de 40 gramas. Assim:

Por essa regra de três, vê-se que:
40 x = 8
x = 8 / 40
x = 0,2 mol NaOH
Da parte do volume, vamos relembrar que cada 1000 mL correspondem a 1 L; assim, 500 mL correspondem a 0,5 L.
Utilizando esses dados na fórmula da molaridade:
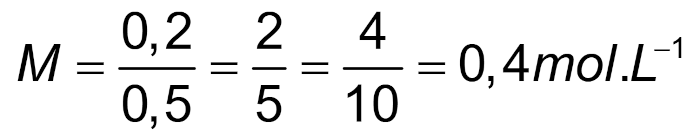
Uso da molaridade no cotidiano
Tirando a indústria química, que utiliza e projeta suas soluções utilizando-se da molaridade, dificilmente é possível perceber soluções cotidianas expressas em mol.L−1, visto que a molaridade deriva do “mol”, uma unidade de quantidade não utilizada nos produtos diversos que consumimos. Nesse caso, é mais comum a expressão da concentração das misturas em termos de concentração comum (g.L−1 e derivados) ou unidades percentuais.
Qual a diferença entre molaridade e molalidade?
Enquanto a molaridade expressa a quantidade da substância, em mols, dividida pelo volume de solução, a molalidade expressa a quantidade da susbstância, em mols, dividida pela massa da solução. Embora pareçam muito semelhantes, devemos recordar que a densidade se altera de acordo com a composição química da solução e, além disso, forças intermoleculares podem interferir no volume final da solução.
Por exemplo, ao se misturar 500 mL de água com 500 mL de etanol, o volume final da solução é de 970 mL, por conta das intensas interações intermoleculares do tipo ligação de hidrogênio.
Por isso, a quantidade de soluto é diferente se a molaridade ou a molalidade forem iguais a 1. Para saber mais sobre molalidade, clique aqui.
Qual a diferença entre molaridade e concentração comum?
Enquanto a molaridade expressa a quantidade da substância, em mols, dividida pelo volume de solução, a concentração comum expressa a quantidade de substância, em gramas, dividida pelo volume da solução. A concentração comum está mais presente em nosso cotidiano. Por exemplo, ao se ler um rótulo de uma garrafa de água mineral, vê-se que a composição química dos compostos é dada, por exemplo, em mg.L−1. Contudo, a interconversão entre concentração comum e molaridade é muito comum, sendo utilizada a seguinte fórmula:
\(C = M \cdot MM\)
- C → concentração comum, M é a molaridade e MM é a massa molar do soluto.
Para saber mais sobre concentração comum, clique aqui.
Exercícios resolvidos sobre molaridade ou concentração molar
Questão 1
(Famerp) A tabela nutricional de determinado refrigerante indica a presença de 21 g de sacarose (C12H22O11) a cada 200 mL da bebida.
Considerando que a massa molar da sacarose é 342 g/mol, a concentração desse soluto no refrigerante é de, aproximadamente,
A) 0,2 mol/L.
B) 1,0 mol/L.
C) 0,5 mol/L.
D) 0,3 mol/L.
E) 0,1 mol/L.
Resolução:
Alternativa D
Se a massa molar da sacarose é de 342 g/mol, o número de mols pode ser calculado pela fórmula n = m/MM, ou seja, número de mols é a massa dividida pela massa molar. Fazendo-se então n = 21/342, temos que o número de mols é aproximadamente igual a 0,06 mol. Tendo-se 200 mL de volume, é possível concluir que ele é igual a 0,2 L. Assim, a molaridade será dada por M = n/V, ou seja, M = 0,06/0,2. O resultado desse quociente é igual a 0,3 mol/L.
Questão 2
(Enem PPL) O vinagre vem sendo usado desde a Antiguidade como conservante de alimentos, bem como agente de limpeza e condimento. Um dos principais componentes do vinagre é o ácido acético (massa molar 60 g/mol), cuja faixa de concentração deve se situar entre 4% e 6% (m/v). Em um teste de controle de qualidade foram analisadas cinco marcas de diferentes vinagres, e as concentrações de ácido acético, em mol/L, se encontram no quadro.

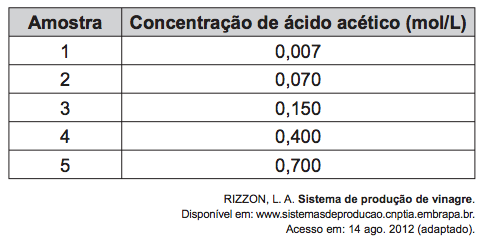
A amostra de vinagre que se encontra dentro do limite de concentração tolerado é a:
A) 1
B) 2
C) 3
D) 4
E) 5
Resolução:
Alternativa E
Se o ácido acético precisa estar entre 4% e 6%, devemos avaliar o que isso corresponde em mol/L para saber qual amostra da tabela estará dentro do permitido.
4% m/v signfica que há 4 gramas de ácido acético para cada 100 mL de solução, assim como 6% m/v significa que há 6 gramas de ácido acético para cada 100 mL de solução. Em termos de concentração comum, podemos afirmar, então, que o limite está entre 40 g/L e 60 g/L.
Utilizando a fórmula C = M . MM para ambos os casos, temos que:
- 40 = M.60 → M ≈ 0,67 mol/L
- 60 = M.60 → M = 1 mol/L
Assim, para uma amostra estar dentro do limite de concentração, ela deve estar entre 0,67 e 1 mol/L. A amostra que obedece a esses critérios é a 5.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, 1994.








