A energia química pode ser entendida como a energia envolvida em um processo químico. É sabido que os compostos químicos são mantidos por ligações e interações químicas, as quais acarretam energias potencial e cinética. Em um processo químico, essa energia pode ser transformada em outras modalidades de energia, tais como calor e elétrica.
A energia química é essencial para entender como uma energia pode ser produzida ou utilizada em uma reação química. Sua compreensão permite entender também como podemos extrair energia dos alimentos que ingerimos e utilizá-la na síntese de moléculas essenciais para nossa vida.
Leia também: Afinal, o que é uma reação química?
Tópicos deste artigo
- 1 - Resumo sobre energia química
- 2 - Videoaula sobre energia química
- 3 - O que é energia química?
- 4 - Exemplos de energia química
- 5 - Tipos de energia química
- 6 - Energia química dos alimentos
- 7 - Energia química e calor
- 8 - Exercícios resolvidos sobre energia química
Resumo sobre energia química
- A energia química é a energia envolvida nos processos químicos.
- Ela é consequência direta das ligações químicas e das interações existentes entre compostos.
- O balanço eletrostático, consequência das forças atrativas e repulsivas entre átomos e moléculas, além da movimentação deles, acarreta níveis de energias potencial e cinética.
- A energia química é importante para a compreensão do nosso metabolismo, pois é proveniente de reações envolvendo a molécula de ATP.
- A maior parte das reações químicas envolve a transferência de energia na forma de calor, assim sendo, é comum que sistemas químicos absorvam ou liberem calor ao longo de uma reação.
Videoaula sobre energia química
O que é energia química?
A energia química é uma forma de se fazer referência às energias envolvidas em processos químicos. Compostos iônicos e moleculares são mantidos por meio de um balanço eletrostático, em que as forças atrativas (por meio de ligações ou interações interatômicas, intermoleculares e interiônicas) superam as forças repulsivas.
Além disso, os compostos não estão parados (vibram, rotacionam e translacionam), ou seja, podemos perceber, de forma simplificada, que os compostos químicos possuem uma combinação de energias potencial (em decorrência do balanço eletrostático) e cinética (em decorrência dos movimentos citados).
Alguns autores se utilizam dessa combinação das energias potencial e cinética para definirem energia química, ou seja, a energia química é a energia que está contida nos compostos químicos.
Quando ocorre um processo químico, a natureza das ligações e interações se altera, em que algumas são quebradas e outras são formadas, havendo, de forma global, absorção de energia ou liberação de energia, sem que haja desrespeito à conservação de energia.
Na maioria das vezes, a liberação ou absorção de energia nos processos químicos ocorre por meio da transferência de calor; mas também pode haver envolvimento de outras modalidades de energia, como a elétrica (como no caso das pilhas e da eletrólise).
Exemplos de energia química
A energia química envolvida em um processo é muito dependente do balanço energético que ocorre por conta da quebra e formação de ligações químicas. Em termos de ligação covalente, a tabela a seguir traz o valor para a energia química de ligação entre alguns átomos.
|
Ligação |
Energia de ligação (kJ.mol-1) |
|
H─H |
436 |
|
C─C |
346 |
|
Cl─Cl |
242 |
|
O=O |
498 |
|
N≡N |
946 |
Apenas para se ter noção, imagine uma bola de futebol de 440 gramas. A energia necessária para se romper 1 mol de ligações entre dois átomos de hidrogênio seria suficiente para elevar essa bola verticalmente em incríveis 101 quilômetros de acordo com a fórmula da energia potencial (Ep = mgh).
No caso de compostos iônicos, a energia química está correlacionada às atrações entre íons de cargas opostas. A energia necessária para separar esses íons é chamada de energia de dissociação (ou energia de rede). Alguns valores estão na tabela a seguir.
|
Composto |
Energia de dissociação (kJ.mol-1) |
|
NaCl |
769 |
|
FeBr2 |
2515 |
|
LiH |
916 |
|
KNO3 |
685 |
|
Ag2S |
2606 |
Em geral, a energia química associada a compostos iônicos é maior por conta da natureza da atração eletrostática entre os íons, cuja força pode ser mensurada pela lei de Coulomb.
Veja também: O que pode alterar a velocidade de uma reação química?
Tipos de energia química
Pensando em energia química como a energia envolvida nos processos químicos, podemos tipificar a energia envolvida de acordo com o mecanismo reacional que ocorre. Por exemplo, durante a queima de um combustível, convencionamos a energia liberada no processo como energia de combustão.
Sendo assim, uma energia de dissolução ácida é a energia química envolvida na dissolução de um ácido em solução. Da mesma forma, uma energia de isomerização é a energia química envolvida na conversão de um isômero em outro.
Por isso, não é possível elencar todos os tipos de energia química existentes, mas sim identificá-los de acordo com o processo reacional que está ocorrendo para entender como a energia química está sendo produzida ou utilizada.
Energia química dos alimentos
Os alimentos são fontes energéticas para seres vivos, pois possuem em sua constituição moléculas que poderão liberar energia para o funcionamento do organismo, tais como carboidratos, gorduras e proteínas.
Ao nos alimentarmos, tais moléculas são degradadas em um processo do metabolismo conhecido como catabolismo. A principal molécula relacionada à transferência e conversão de energia no metabolismo é a adenosina trifosfato (ATP). Ela é sintetizada em uma reação conhecida como fosforilação do ADP, que pode ocorrer por dois mecanismos.
O primeiro, conhecido como fosforilação oxidativa, ocorre nas mitocôndrias e exige a presença de oxigênio molecular, e é responsável pela síntese da maior parte de ATP utilizado. Neste, o fosfato de fosfoenolpiruvato reage com uma molécula de ADP, e, com auxílio da enzima piruvato quinase, há a formação de piruvato e ATP.
O segundo mecanismo, conhecido como fosforilação do substrato, ocorre quando a base de Lewis HPO42- (hidrogenofosfato) proveniente de um intermediário reage com o ADP2-, formando o ATP4- e tendo água como subproduto.
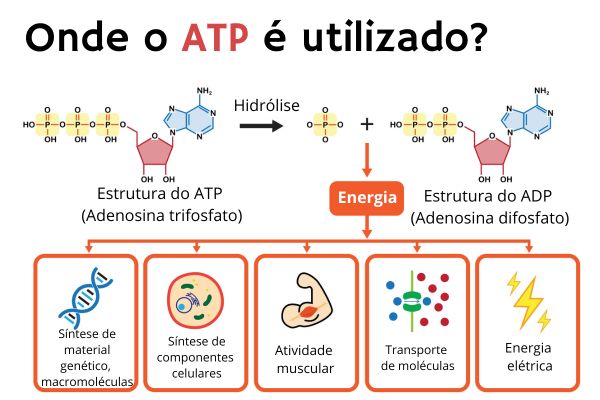
O ATP pode se reconvertido em ADP por meio de uma reação de hidrólise. No balanço energético, há a liberação de 7,3 kcal para cada mol de ATP envolvido no processo. É essa energia que será utilizada no anabolismo, outra etapa do metabolismo em que as unidades fundamentais são reunidas para formar as macromoléculas componentes das células, tais como proteínas, DNA etc.
Saiba mais: Processos endotérmicos e exotérmicos — qual a diferença?
Energia química e calor
Boa parte das reações químicas envolve transferência de energia na forma de calor. Para desencadear um processo químico, faz-se necessário um gatilho energético, conhecido como energia de ativação. É essa energia que será utilizada para romper as ligações químicas existentes nos compostos.
Para superar tal energia química, é comum a absorção de calor da vizinhança (processo endotérmico), o que acarreta o aumento da energia cinética das moléculas, assim, causando o rompimento das ligações.
Quando novas ligações são formadas, os compostos acabam perdendo grau de liberdade de movimentação e, como consequência, a energia cinética é perdida. Também perdem energia potencial por conta dos efeitos de atração entre núcleos e eletrosferas e/ou cargas opostas. Com isso, é também comum que essa energia seja perdida na forma de calor (processo exotérmico).

Por vezes, a energia liberada na forma de calor acaba sendo maior que a energia necessária para quebra das ligações e, por isso, definimos que a reação química é exotérmica. Do contrário, quando a energia absorvida na forma de calor para o desencadeamento da reação é maior que a quantidade liberada na estabilização dos novos compostos, definimos que a reação química é endotérmica.
Exercícios resolvidos sobre energia química
Questão 1 (PUC-GO Medicina/2023) Leia o texto a seguir sobre a reação de produção de gás carbônico:
Mesmo submetido a alta pressão, um novo catalisador à base de níquel, zinco e carbono conseguiu transformar dióxido de carbono, um dos principais gases de efeito estufa, em monóxido de carbono, um importante intermediário para gerar produtos de valor agregado. “O resultado da nossa pesquisa mostra que estamos cada vez mais próximos de produzir, por meio da catálise, derivados de petróleo, como plásticos e combustíveis”, comemora Liane Rossi, professora do Instituto de Química da USP e coordenadora do estudo realizado no âmbito do Fapesp Shell Research Centre for Gas Innovation.
[...]
[...] Na oportunidade, os pesquisadores descobriram que um catalisador de níquel teve melhor desempenho após ser submetido à alta temperatura (800 graus Celsius), em atmosfera de dióxido de carbono e hidrogênio ou então de metano ou propano. “Esse processo possibilitava um excelente catalisador para a redução de dióxido de carbono: ele gerava exclusivamente monóxido de carbono, sem sinal do produto menos desejável, que é o metano”, aponta Liane.
(Disponível em: https://jornal.usp.br/ciencias/cientistas-da-uspestao-cada-vez-mais-perto-de-transformar-gas-carbonico-emcombustiveis-ou-plasticos-via-catalise/ Acesso em: 18 ago. 2022. Adaptado.)
Leve em conta as informações apresentadas e analise os itens que seguem:
I - Em uma reação química, temos alteração na energia interna das substâncias. Esta é dividida em duas partes: energia química (forças no núcleo do átomo) e energia térmica (movimento de translação, rotação e vibração de átomos e moléculas).
II - Em uma reação química, quando a energia interna total dos reagentes for maior que a energia interna total dos produtos formados, haverá um excedente de energia que será liberado em forma de calor, reação exotérmica.
III - Em uma reação química, o estado físico em que os produtos são formados altera a entalpia da reação, pois parte da energia que é liberada ou absorvida durante a reação fica na forma de agitação térmica dos átomos e/ou moléculas.
Considerando os itens apresentados, assinale a única alternativa que reúne a totalidade dos itens corretos quanto às reações químicas:
A) ( ) II e III apenas.
B) ( ) III apenas.
C) ( ) I apenas.
D) ( ) I e II apenas
Resposta: Letra A
Apesar de, em uma reação química, termos a alteração da energia interna das substâncias, a energia térmica não é considerada como o movimento de translação, rotação etc., mas sim a energia cinética. Por isso, a primeira afirmativa está incorreta.
Questão 2 (Etec) Energia química é proveniente das ligações químicas entre átomos que são feitas para formar algo. Sendo assim, como tudo no mundo é formado por átomos, tudo tem energia química. Essa energia é manifestada quando acontecem ligações químicas e também quando há rupturas dessas ligações.
Apesar de estar em todos os lugares, a energia química não se manifesta o tempo todo e depende de quais moléculas estarão envolvidas no processo.
Quando consumimos um alimento, por exemplo, parte da sua energia é transformada pelo nosso organismo e a outra é liberada em forma de calor.
<http://tinyurl.com/z8mraow> Acesso em: 10.02.2016. Adaptado.
De acordo com o texto, assinale a alternativa correta.
A) A energia química é liberada constantemente, pois está em todos os lugares.
B) A energia química se manifesta somente na ruptura das ligações químicas.
C) Parte da energia armazenada no alimento é transformada pelo organismo.
D) Parte da energia armazenada no alimento é absorvida na forma de calor.
E) Apenas em alguns compostos químicos existe energia química.
Resposta: Letra C
A alternativa A está incorreta, pois a energia química não é liberada constantemente, mas apenas durante reações químicas.
A alternativa B está incorreta porque a energia química se manifesta também na formação das ligações químicas.
A alternativa D está incorreta porque a energia dos alimentos não é absorvida na forma de calor, mas sim transformada, em parte, pelo nosso organismo para a síntese de moléculas que terão função energética no metabolismo.
A alternativa E está incorreta porque a energia química está presente em todos os compostos químicos.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DE OLIVEIRA, R. J.; SANTOS, J. M. A Energia e a Química. Química Nova Na Escola. n. 8. Nov. 1998.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.
UNIVERSIDADE DO ESTADO DE SÃO PAULO – UNESP. Introdução ao Metabolismo. Disponível em: https://www.dracena.unesp.br/Home/Graduacao/introducao_metabolismo.pdf


