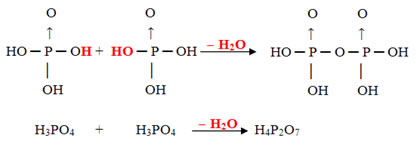
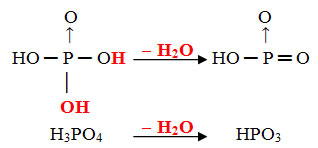
Grau de hidratação dos ácidos
A nomenclatura dos ácidos pode ser dada de acordo com o grau de hidratação deles, usando-se os prefixos orto, piro e meta.

O ácido ortofosfórico possui a seguinte fórmula molecular: H3PO4. A partir dela, assinale a alternativa que indica o ácido pirofosfórico e o ácido metafosfórico, respectivamente:
- H6P2O8 e HPO2
- H6P2O8 e HPO3
- H4P2O7 e HPO3
- HPO3 e H4P2O7
- H4P2O7 e H5PO5
Dê a nomenclatura dos seguintes ácidos:
-
H2SO4
-
H2S2O7
-
H2SO3
-
H3PO4
-
HPO3
-
H3PO3
-
H3PO2
-
H4P2O7
(UFES-ES) Os ácidos com as fórmulas moleculares HPO3, H3PO4 e H4P2O7 são, respectivamente:
a) metafosfórico, ortofosfórico e pirofosfórico.
b) ortofosfórico, metafosfórico e pirofosfórico.
c) ortofosfórico, pirofosfórico e metafosfórico.
d) pirofosfórico, metafosfórico e ortofosfórico
e) pirofosfórico, ortofosfórico e metafosfórico.
(UFMT-MT) Alguns ácidos oxigenados podem formar três ácidos com diferentes graus de hidratação. Estes ácidos recebem prefixos: ORTO, META e PIRO.
O prefixo ORTO corresponde ao ácido que apresenta:
a) menor teor de água na molécula.
b) teor de água intermediário entre o META e o PIRO.
c) maior teor de água na molécula.
d) teor de água menor que o META.
e) teor de água menor que o PIRO.