Grau de hidratação dos ácidos
A nomenclatura dos ácidos pode ser dada de acordo com o grau de hidratação deles, usando-se os prefixos orto, piro e meta.
Pode acontecer de existirem ácidos de um mesmo elemento, sendo que esse elemento possui o mesmo número de oxidação (NOX), mas a diferença consiste nos graus de hidratação.
Por exemplo, abaixo, temos três ácidos formados pelo elemento fósforo (P):
H3PO4 H4P2O7 HPO3
Observe que nos três ácidos o número de oxidação do fósforo é +5; a diferença está no grau de hidratação.
Baseado nisso, esses ácidos são diferenciados na nomenclatura por meio dos prefixos orto, piro e meta.
O ácido mais hidratado é chamado de orto. No exemplo dado, o primeiro (H3PO4) é denominado de ácido ortofosfórico, porque é o mais hidratado dos três. O prefixo orto é dispensável, por isso, na maioria das vezes, esse ácido será chamado apenas de ácido fosfórico.
Os prefixos piro e meta são usados tendo o ácido orto como ponto de referência:
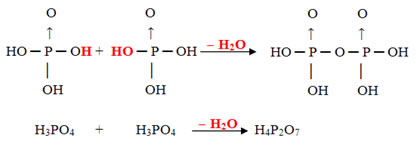
- Piro: 2 moléculas de orto menos 1 molécula de H2O
Exemplo: O H4P2O7 é denominado de ácido pirofosfórico porque ele é igual a duas moléculas do ácido ortofosfórico (H3PO4) menos uma molécula de água.
2 . H3PO4 =H6P2O8
H6P2O8 - H2O = H4P2O7
Esse processo é uma desidratação intermolecular:
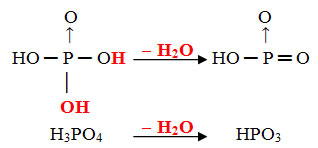
- Meta: 1 molécula de orto menos 1 molécula de H2O
Exemplo: O HPO3 é denominado de ácido metafosfórico porque ele é igual a uma molécula do ácido ortofosfórico (H3PO4) menos uma molécula de água.
H3PO4 - H2O = HPO3
Esse processo é uma desidratação intramolecular:
Por Jennifer Fogaça
Graduada em Química
Fonte: Brasil Escola - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm