Ácidos se fazem muito presentes em nosso cotidiano, estão presentes até mesmo na nossa alimentação, como por exemplo, nas frutas cítricas encontramos os ácidos cítrico e ascórbico (vitamina C).
Vejamos as características e utilização dos ácidos mais comuns:
Ácido sulfúrico (H2SO4): ácido forte (altamente corrosivo) consumido em enormes quantidades na indústria petroquímica, na fabricação de papel, corantes e baterias de automóveis.
Ácido fosfórico (H3PO4): os sais (fosfatos e superfosfatos) derivados deste ácido têm grande aplicação como fertilizantes na agricultura.
.jpg)
Ácido fluorídrico (HF): esse ácido possui a capacidade de corroer o vidro, sendo por isso armazenado apenas em frascos de polietileno.
Em virtude de propriedade de corrosão, o ácido fluorídrico é usado para gravar sobre vidro. Os vidros de automóveis têm uma numeração na parte inferior, esta é gravada com o auxílio desse ácido.
Ácido nítrico (HNO3): um dos ácidos mais fabricados e consumidos pela indústria.

Utilização: fabricação de explosivos, como nitroglicerina (dinamite), trinitrotolueno (TNT), trinitrocelulose (algodão pólvora), salitre (NaNO3, KNO3) e da pólvora negra (salitre + carvão + enxofre).
Ácido clorídrico (HCl): reagente muito usado na indústria e no laboratório.
Na construção civil é usado para remover respingos de cal (após a caiação) de pisos e azulejos. Neste caso é mais conhecido como ácido muriático: agente de limpeza de alta potencialidade.
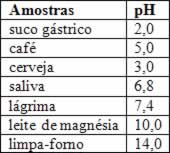
O HCl se faz presente em nosso próprio corpo. É encontrado no suco gástrico e tem o papel de auxiliar na digestão.
Ácido acético (CH3COOH): ácido componente do vinagre, tempero indispensável na cozinha, usado no preparo de saladas e maioneses.

Ácido carbônico (H2CO3): as águas e refrigerantes gaseificados têm seu diferencial (mais refrescante) graças a este ácido, ele é formado na reação do gás carbônico com a água:
CO2 + H2O → H2CO3
Por Líria Alves
Graduada em Química