Fórmula molecular é uma modalidade de fórmula química que apresenta os constituintes do composto molecular, assim como suas respectivas quantidades na unidade molecular. Nessa fórmula, os compostos são colocados em ordem crescente de eletronegatividade, enquanto suas respectivas quantidades ficam subscritas.
A fórmula molecular de um composto desconhecido pode ser descoberta por métodos analíticos, mas, no dia a dia da prática acadêmica, é possível determiná-la direta ou indiretamente por meio da análise de outras fórmulas químicas, como a fórmula estrutural, a fórmula mínima e a fórmula centesimal.
Leia também: Quais são as fórmulas estruturais do carbono?
Tópicos deste artigo
- 1 - Resumo sobre fórmula molecular
- 2 - Videoaula sobre fórmula molecular
- 3 - O que é fórmula molecular?
- 4 - Como descobrir a fórmula molecular?
- 5 - O que a fórmula molecular indica?
- 6 - Como escrever a fórmula molecular?
- 7 - Fórmula molecular e fórmula centesimal
- 8 - Diferenças entre fórmula molecular e fórmula estrutural
- 9 - Exercícios resolvidos sobre fórmula molecular
Resumo sobre fórmula molecular
- A fórmula molecular é uma modalidade de fórmula química que apresenta os elementos que participam do composto molecular, bem como suas respectivas quantidades.
- Os elementos são dispostos em ordem crescente de eletronegatividade e suas quantidades, chamadas de atomicidade, são representadas por valores subscritos.
- Compostos cuja identidade ainda não se conhece podem ter sua fórmula molecular determinada pela utilização de métodos analíticos.
- No cotidiano acadêmico, fórmulas moleculares podem ser obtidas de outras fórmulas químicas, como a centesimal, a estrutural e a mínima.
Videoaula sobre fórmula molecular
O que é fórmula molecular?
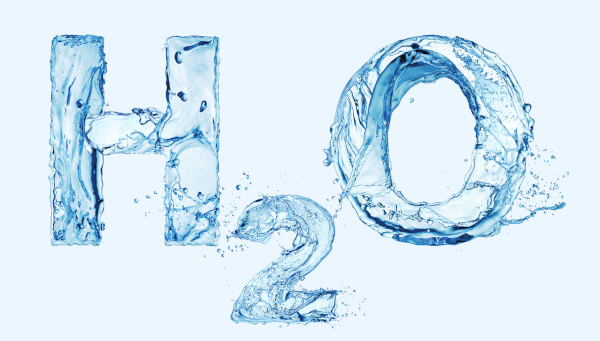
A fórmula molecular é um tipo de fórmula química que apresenta não só os constituintes de um composto molecular como também as suas quantidades por molécula, a chamada atomicidade. Na representação, os símbolos dos elementos são colocados, geralmente em ordem crescente de eletronegatividade, com as suas atomicidades subscritas.
Por exemplo, a molécula de água é composta por 2 átomos de hidrogênio, H, e 1 átomo de oxigênio, O, assim sendo, a sua fórmula molecular é:
H2O
Repare que o número 2 que está subscrito indica o número de átomos de hidrogênio na unidade molecular, enquanto o oxigênio, por só ter um único átomo, não necessita de numeração.
Outro exemplo é do etanol (álcool etílico), composto por 2 átomos de carbono, 6 átomos de hidrogênio e 1 átomo de oxigênio, ficando então com a fórmula C2H6O.
Como descobrir a fórmula molecular?
A fórmula molecular pode ser descoberta de forma direta ou indireta, a depender dos recursos que você possui. No cotidiano da ciência, existem técnicas analíticas que permitem chegar às fórmulas de compostos conhecidos ou desconhecidos, como técnicas de infravermelho, espectroscopia por ressonância magnética nuclear (RMN), cromatografia gasosa ou líquida, espectroscopia de ultravioleta/visível (UV-vis), além da espectrometria de massa.
Já no dia a dia do estudante, algumas pequenas análises podem ser feitas para se chegar à fórmula molecular.
-
Pela fórmula estrutural
Por exemplo, caso lhe tenha sido demonstrada a fórmula estrutural de um composto, a simples contagem dos elementos por unidade o levará à fórmula molecular. A seguir, por exemplo, temos a fórmula estrutural do ácido nítrico.
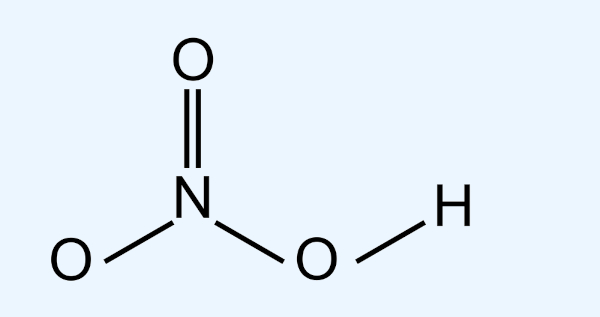
Percebe-se, ao avaliar-se a fórmula estrutural, que no ácido nítrico há 3 átomos de oxigênio, 1 átomo de nitrogênio e 1 átomo de hidrogênio. Assim, a fórmula molecular é HNO3.
-
Pela fórmula mínima
Também é possível, em posse da fórmula mínima e da massa molar, determinar a fórmula molecular do composto. Por exemplo: suponha que a fórmula mínima de um composto seja CH3, porém sua massa molar é 30 g/mol. Como determinar a fórmula molecular nesse caso?
- A massa molar da fórmula mínima é igual a MM(C) + 3.MM(H) = 12 + 3(1) = 15 g/mol.
- Agora, deve-se dividir a massa molar do composto de que se deseja conhecer a fórmula molecular pela massa molar da fórmula mínima: 30/15 = 2.
- Assim, são necessárias 2 unidades de fórmula mínima para se chegar ao composto em questão, portanto, o composto é formado por 2 carbonos e 6 hidrogênios, ou seja, C2H6.
-
Pela fórmula centesimal
Também é possível determinar a fórmula molecular tendo os dados da fórmula centesimal, que apresenta a composição percentual mássica de um composto. Por exemplo, suponha que um composto apresente 60% em massa de carbono, 13,3% em massa de hidrogênio e 26,7% em massa de oxigênio.
Nesse caso, determina-se a fórmula molecular da seguinte forma:
- Divide-se o percentual mássico pela massa molar de cada componente:
- Carbono: 60/12 = 5
- Hidrogênio: 13,3/1 = 13,3
- Oxigênio: 26,7/16 = 1,67
- Como as fórmulas moleculares são escritas com números inteiros apenas, deve-se pegar o menor número obtido e dividir todos os resultados por ele. No caso, o menor número obtido foi 1,7. Espera-se, então, que os números obtidos fiquem bem próximos a números inteiros.
- Carbono: 5/1,67 = 2,99 \(\approx\) 3
- Hidrogênio: 13,3/1,67 = 7,96 \(\approx\) 8
- Oxigênio: 1,67/1,67 = 1
- Assim, vê-se que tal composto tem 3 átomos de carbono, 8 átomos de hidrogênio e 1 átomo de oxigênio, sendo identificado como C3H8O.
Veja também: Como é feita a classificação dos elementos na Tabela Periódica?
O que a fórmula molecular indica?

A fórmula molecular nos serve para indicar não só os átomos existentes em uma molécula, como também as suas quantidades. Por exemplo, na fórmula H2SO4 é possível perceber que os elementos presentes são hidrogênio, H, enxofre, S, e oxigênio, O. O número subscrito, chamado de atomicidade, indica a quantidade de átomos nessa molécula.
Quando não houver número algum, entendemos que a quantidade é igual a 1. Assim, nessa molécula existem 2 átomos de hidrogênio, 1 átomo de enxofre e 4 átomos de oxigênio.
H2SO4
- 2 átomos de hidrogênio
- 1 átomo de enxofre
- 4 átomos de oxigênio
Como escrever a fórmula molecular?
Para uma fórmula molecular ser devidamente escrita, devemos colocar os elementos em ordem crescente de eletronegatividade. Outro ponto importante é que as atomicidades só podem ser compostas por números inteiros.
Por isso, devemos escrever HNO3 e não NO3H, uma vez que o hidrogênio é o menos eletronegativo desse composto, enquanto o oxigênio é o mais eletronegativo. A única exceção é a química orgânica, pois, como é uma área dedicada aos compostos de carbono, esse elemento sempre inicia a fórmula molecular, sendo ele o mais eletronegativo ou não.
O flúor, por exemplo, é o elemento mais eletronegativo da Tabela Periódica, ficando sempre no final da fórmula, como no caso do composto O2F2.
Fórmula molecular e fórmula centesimal
A fórmula centesimal, como o nome deixa a entender, exprime o percentual mássico de participação de cada elemento presente na molécula. Obviamente, o somatório da participação de cada elemento deve ser igual a 100.
Por exemplo, na água, H2O, a massa molar é igual a 18 g/mol. Contudo, desses 18 gramas, 2 gramas são respectivos aos 2 átomos de hidrogênio e 16 gramas são respectivos ao átomo de oxigênio.
Para se obter o percentual de cada elemento, deve-se dividir a sua participação em massa pela massa total da molécula e depois multiplicar o valor por 100, de modo que fique em porcentagem. Por isso, em termos centesimais:
%H = (2/18) x 100 = 11,11%
%O = (16/18) x 100 = 88,89%
Alguns autores gostam de utilizar uma notação semelhante para fórmula molecular, em que as atomicidades são substituídas pela parte centesimal. No caso da água, então, ficaria:
H11,11%O88,89%
Diferenças entre fórmula molecular e fórmula estrutural
O objetivo da fórmula estrutural é explicitar as ligações covalentes que estão sendo realizadas na molécula, ou seja, não só identificar qual elemento está se ligando com qual elemento, como também indicar se essas ligações serão simples, duplas ou triplas.
Em Química orgânica, as fórmulas estruturais são muito mais utilizadas que as fórmulas moleculares. Isso porque têm a vantagem de conseguir expor a função orgânica que pertence à substância e demonstrar diferenças estruturais importantes, algo muito útil no caso de isômeros, que são compostos diferentes, mas que têm a mesma a fórmula molecular. Assim, as fórmulas estruturais trazem uma melhor compreensão de um composto orgânico.
Saiba mais: Como ocorrem as ligações químicas?
Exercícios resolvidos sobre fórmula molecular
Questão 1. (Unieva Medicina/2023.1) Os fenóis são compostos orgânicos com uma ou mais oxidrilas (OH) ligadas diretamente ao anel aromático. Alguns dos fenóis são encontrados na natureza, como o eugenol, vanilina, timol e outros. O eugenol é um óleo essencial, presente em diversas espécies vegetais, inclusive no cravo-da-índia e tem despertado o interesse das indústrias farmacêutica e odontológica devido a suas propriedades anti-inflamatória, antimicrobiana e neuroprotetora.
A composição centesimal do Eugenol é de 73,20% de Carbono (C), 7,32% de Hidrogênio (H) e 19,48% de Oxigênio (O), aproximadamente. A sua massa molecular é de 164 g.
Considerando o exposto, a quantidade de C, H e O (aproximadamente), encontrada, constitui a fórmula molecular do eugenol, que é
- C10H12O2.
- C12H12O3.
- C10H14O.
- C12H10O2.
Resposta: Letra A.
Por meio da fórmula centesimal, é possível fazer:
Carbono: 73,20/12 = 6,1
Hidrogênio: 7,32/1 = 7,32
Oxigênio: 19,48/16 = 1,22
Dividindo-se pelo menor valor encontrado, temos que:
Carbono: 6,1/1,22 = 5
Hidrogênio: 7,32/1,22 = 6
Oxigênio: 1,22/1,22 = 1
Chega-se à fórmula C5H6O. Contudo, o exercício deixa claro que a fórmula molecular é 164 g/mol, e a fórmula encontrada tem massa molar igual a 82 g/mol. Isso quer dizer, então, que o composto a ser observado é equivalente a 2 vezes a fórmula C5H6O, sendo então C10H12O.
Questão 2. (UEA-SIS 1ª Etapa/2022) A vitamina C é uma substância muito importante para a manutenção da saúde do nosso sistema imunológico. Essa molécula, de massa molar 176 g/mol, é constituída por átomos de carbono, hidrogênio e oxigênio (CxHyOz) e sua fórmula mínima é C3H4O3.
A fórmula molecular da vitamina C é:
- C3H4O3
- C4H3O4
- C5H10O5
- C6H8O6
- C9H12O9
Resposta: Letra D.
A massa molar da fórmula mínima, C3H4O3, é igual a 88 g/mol. Esse valor é a metade de 176 g/mol, a massa molar da vitamina C. Assim sendo, a fórmula molecular da vitamina C corresponde ao dobro da fórmula mínima, sendo então C6H8O6.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FELTRE, R. Química. V. 1, 6ª ed. Moderna: São Paulo, 2004.


