
Às vezes pode acontecer de a fórmula mínima ser igual à fórmula molecular do composto; no entanto, isso nem sempre é verdadeiro.
Por exemplo, a fórmula empírica ou mínima da água é H2O, indicando que há a proporção de 2:1 entre os elementos que formam as moléculas de água. E, coincidentemente, essa também é a fórmula molecular da água. Porém, para você ver que isso não ocorre sempre, observe os dois exemplos a seguir:
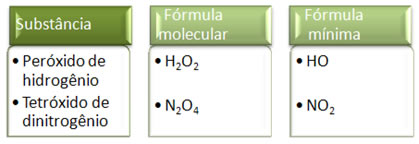
Visto que a fórmula mínima é somente a relação dos átomos de cada elemento e não a quantidade real deles na fórmula molecular, pode ocorrer de compostos diferentes terem a mesma fórmula empírica e até mesmo a fórmula mínima de um composto pode ser igual à fórmula molecular de outro. Observe, no exemplo abaixo, como isso pode ocorrer:
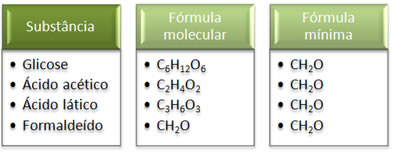
Veja que a fórmula mínima CH2O é a mesma para todas as substâncias, isto é, essa fórmula mínima expressa que, em todos os casos, os átomos de carbono, hidrogênio e oxigênio estão presentes nas fórmulas moleculares em uma relação de 1:2:1. Além disso, o único que apresenta a fórmula molecular igual à fórmula empírica é o formaldeído.
- Cálculo da Fórmula Mínima ou Empírica:
Para determinar a fórmula empírica de um composto é necessário saber primeiro qual é a sua fórmula percentual ou centesimal. Isso pode ser feito medindo a massa de cada elemento em 100g de uma amostra. O texto “Fórmula Percentual ou Centesimal” esclarece melhor esse assunto.
Por exemplo, digamos que a composição centesimal de determinado composto é dada por: 40,00% de C, 6,67% de H e 53,33% de O. Passamos esses valores para grama, considerando uma massa de 100 g de amostra do composto. Assim, temos: 40 g de C, 6,67 g de H e 53,33 g de O.
Agora é necessário passar esses valores para a quantidade de matéria (mol). Fazemos isso dividindo cada um dos valores encontrados por suas respectivas massas molares:
C: 40/12 = 3,33
H: 6,67/1 = 6,67
O: 53,33/16 = 3,33
Visto que os valores não são inteiros, usamos o seguinte artifício: dividimos todos os valores pelo menor deles, pois dessa maneira a proporção existente entre eles não é alterada.
Nesse caso, o menor valor é 3,33, de modo que o resultado será:
C: 3,33/3,33 = 1
H: 6,67/3,33 = 2
O: 3,33/3,33 = 1
Assim, a fórmula mínima dessa substância desconhecida é igual a: C1H2O1 ou CH2O.
Resumidamente, os passos necessários para encontrar a fórmula empírica ou mínima de uma substância são:

Por Jennifer Fogaça
Graduada em Química



