Cálculos estequiométricos são a relação de quantidade de substâncias que reagem entre si em um processo químico e as quantidades de produtos que são formadas. Tais quantidades são avaliadas mediante uma equação estequiométrica, que é a representação esquemática da reação ou processo químico. A equação estequiométrica correlaciona os participantes da reação química em proporções molares fixas e determinadas.
Os cálculos estequiométricos podem ser realizados de diversas formas, contudo entende-se que desenvolver metodologias auxilia na sua compreensão e realização. A ideia central é predizer a quantidade de um produto formado ao longo de um processo químico ou estimar quanto de reagente será necessário para a produção de determinada massa de produto.
Leia também: Rendimento de uma reação — a razão entre o produto realmente obtido e a quantidade que teoricamente seria obtida
Tópicos deste artigo
- 1 - Resumo sobre cálculos estequiométricos
- 2 - O que são cálculos estequiométricos?
- 3 - Como fazer os cálculos estequiométricos?
- 4 - Exercícios resolvidos sobre cálculos estequiométricos
Resumo sobre cálculos estequiométricos
- Cálculos estequiométricos são a relação entre as quantidades de substâncias que reagem entre si em um processo químico e a quantidade de produtos que são formados.
- Por meio dos cálculos estequiométricos é possível prever a quantidade em mols, o volume ou a massa de um produto que será formado ou de um reagente que será utilizado.
- Os participantes de uma reação reagirão de forma proporcional, enunciada por uma equação estequiométrica.
- Diversas são as formas as quais os cálculos estequiométricos podem ser realizados, por isso é essencial o desenvolvimento de metodologias que mais se adequem ao seu jeito de fazer os cálculos.
O que são cálculos estequiométricos?
Cálculos estequiométricos são a relação entre quantidades de substâncias que reagem entre si em um processo químico particular e as quantidades de produtos que são formadas. Para avaliação da estequiometria da reação, o processo químico é enunciado mediante uma equação estequiométrica, cuja estrutura geral é a que segue:
a A + b B + ... → ... + y Y + z Z
Vê-se pela equação que um número “a” de mols da substância A reage com um número “b” de mols da substância B, entre outras, para produzir “y” mols da substância Y, “z” mols da substância Z, entre outras. O problema é que nem sempre a estequiometria da reação é conhecida ou, por vezes, é bastante complexa.
Na maioria das vezes, apenas representamos a estequiometria principal do processo, omitindo subprodutos, além de não conseguirmos expressar a variação da estequiometria do processo ao longo do tempo, ou seja, a dependência do processo químico à sua cinética.
Como fazer os cálculos estequiométricos?
O objetivo de um exercício de estequiometria é, em geral, predizer a quantidade de um produto formado ao longo de um processo químico ou estimar o quanto de reagente será necessário para a produção de determinada massa de produto.
Vejamos, por exemplo, o caso a seguir, em que se busca calcular a quantidade de dióxido de carbono gerado na queima de certa quantidade de etanol combustível.
|
Quantos gramas de CO2 são produzidos na queima de 184 gramas de etanol? C2H6O + O2 → CO2 + H2O |
A metodologia para a resolução envolve, quase sempre, cinco etapas básicas. Acompanhe a seguir.
→ 1ª etapa: balancear a reação química
Só é possível fazer uma análise quantitativa de um processo químico se a reação química estiver devidamente balanceada. Balancear uma reação química significa ir ao encontro da lei da conservação de massas, enunciada por Antoine Lavoisier (na natureza, nada se cria, nada se perde, tudo se transforma).
Ao balancear, ajustamos os coeficientes estequiométricos da reação, que consistem em números que são colocados antes de cada substância na equação química. A reação estará balanceada quando as quantidades de átomos presentes nos reagentes forem exatamente iguais às quantidades de átomos presentes nos produtos.
Por vezes, os coeficientes estequiométricos são facilmente determinados. Uma metodologia famosa é a das tentativas, em que os coeficientes são postos mediante tentativa e erro. Para agilizar as tentativas, é comum a utilização de algumas regras e direcionamentos empíricos, sendo a regra do MACHO a mais famosa destes. Nessa regra, devemos balancear os elementos na seguinte ordem: metal, ametal, carbono, hidrogênio e oxigênio. Vamos ver para o caso em questão.
Nessa reação, não há nenhum metal e nenhum ametal diferente de carbono, hidrogênio e oxigênio. Segue então a ordem de carbono, depois hidrogênio e, por último, oxigênio.
- Há 2 carbonos do lado dos reagentes, deve então haver 2 do lado dos produtos.
C2H6O + O2 → 2 CO2 + H2O
- Há 6 hidrogênios do lado dos reagentes, deve então haver 6 do lado dos produtos.
C2H6O + O2 → 2 CO2 + 3 H2O
- Há 7 oxigênios do lado dos produtos, deve então haver 7 do lado dos reagentes.
C2H6O + 3 O2 → 2 CO2 + 3 H2O
Como todos os coefiencientes estequiométricos foram acertados, a reação está balanceada. Repare bem que não se deve alterar os números subscritos das fórmulas químicas, pois isso configura alteração da composição química da substância (H2O é totalmente diferente de H2O2, por exemplo).
→ 2ª etapa: identificar o par de substâncias a ser trabalhado
Em uma reação química, muitas são as substâncias que podem estar envolvidas, e você não necessariamente precisará utilizar todas na resolução do cálculo estequiométrico. Na maioria das vezes, apenas duas substâncias são necessárias: uma da qual se deseja obter informações (quantos gramas de CO2..., conforme visto no enunciado) e uma da qual já se possui informações (na queima de 184 gramas de etanol..., conforme visto no enunciado).
Ou seja, utilizaremos uma informação conhecida do etanol (184 gramas) para saber uma informação desconhecida do CO2 (sua massa gerada).
→ 3ª etapa: montar a regra de três
Os participantes de uma reação química reagem mediante uma proporção fixa, determinada pela lei das proporções fixas, enunciada por Joseph Louis Proust. Ao realizarmos o balanceamento, enxergamos a proporção básica entre os participantes da reação. No caso, para a reação anterior, para cada 1 mol de etanol utilizado, 3 mols de O2 são necessários, produzindo-se 2 mols de CO2 e 3 mols de H2O.
Assim, todos os participantes estão afixados nessa proporção básica, o que quer dizer que variando a quantidade de um, todos devem variar na mesma medida. Por isso, para a análise quantitativa, utilizaremos a regra de três simples, uma ferramenta matemática que trabalha proporção.
Uma regra de três, em geral, possui duas colunas e duas linhas. Uma coluna será da substância de que se possui informação, enquanto a outra coluna será da substância de que se quer obter informação. A primeira linha será preenchida com os coeficientes estequiométricos da reação, ou seja, a proporção básica da reação. Perceba que a reação química sempre demonstra a quantidade em mols. Já a segunda linha colocará as informações do enunciado, trazendo a incógnita do problema (no caso, a massa de CO2, representada por x).
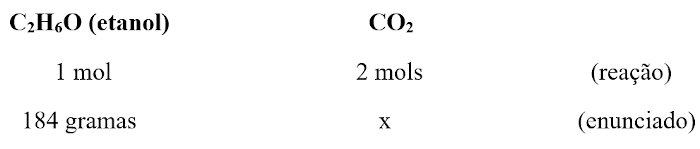
→ 4ª etapa: realizar as conversões de unidades necessárias
Embora seja matematicamente possível realizar a regra de três anterior, devemos lembrar que quimicamente ela não faz sentido. Ao escrever 1⋅ x = 184 ⋅ 2 e assim dizer que x é igual a 368 gramas, afirmamos que etanol e CO2 possuem a mesma massa molar. Entretanto, sabemos que isso não é verdade, pois cada substância possui a sua própria massa molar.
Dessa forma, podemos dizer que não existe proporcionalidade entre mol e massa de substâncias diferentes, sendo necessário padronizar a regra de três — ou ela está com todos os valores em mol, ou ela está com todos os valores em massa.
Para realizar as devidas conversões, lembre-se:
|
Conversão de unidades necessárias nos cálculos estequiométricos |
|
De mol para massa |
|
1 mol é verificado na massa molar (Tabela Periódica) |
|
De mol para volume |
|
1 mol equivale a 22,4 L (nas CNTP) |
Não há caminho correto, pode-se optar tanto por converter a primeira linha, que está em mols, para unidade de massa ou converter a segunda linha, que está em gramas, para mols, que o resultado final será alcançado da mesma forma. Contudo, para diminuir a quantidade de etapas de cálculos, pensemos que o valor de x desejado é uma massa, e, sendo assim, espera-se que ele saia em unidade de massa. Por isso, recomenda-se que a regra de três seja padronizada para unidades de massa, a fim de encontrar o x na unidade desejada.
Então, pela Tabela Periódica, vê-se que:
C: 12 g/mol
H: 1 g/mol
O: 16 g/mol
Massa molar de C2H6O: 2 ⋅ (12) + 6 ⋅ (1) + 1 ⋅ (16) = 24 + 6 + 16 = 46 g/mol
Massa molar de CO2: 1 ⋅ (12) + 2 ⋅ (16) = 12 + 32 = 44 g/mol
Se 1 mol de CO2 equivale a 44 gramas, então 2 mols equivalem a 88 gramas. Fazendo a conversão, a regra de três fica:
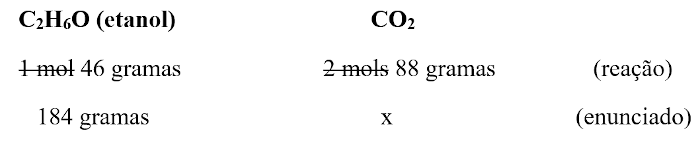
→ 5ª etapa: fazer a regra de três
Com a regra de três padronizada, multiplicam-se os valores de forma cruzada:
46 ⋅ x = 184 ⋅ 88
\(x\ =\ \frac{184\ \cdot\ 88}{46}\)
x = 4 ⋅ 88
x = 352 gramas de CO2
Veja também: Número de Avogadro — uma constante que se relaciona tanto com o número de mols quanto com a massa molar
Exercícios resolvidos sobre cálculos estequiométricos
Questão 1
(Enem)
Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: massa molar em g/mol: C = 12, O = 16, Cu = 64.
A) 2,2 g.
B) 2,8 g.
C) 3,7 g.
D) 4,4 g.
E) 5,5 g.
Resolução:
Alternativa A.
Apesar de não estar explícita, a reação química está descrita no texto do enunciado. Pela análise podemos concluir que a reação é:
CuO + C → Cu + CO2
A reação não está balanceada, e, por isso, faremos o balanceamento:
2 CuO + C → 2 Cu + CO2
Com o balanceamento completo, percebemos que a questão utiliza 8 g de CuO para descobrir uma massa de CO2, que será nossa incógnita (x).
2 mols de CuO ---------------- 1 mol de CO2
8 g de CuO -------------------- x
Como não se misturam mol e massa de substâncias diferentes, parte-se para a conversão de unidades. Como se deseja o valor de x em gramas, converte-se toda a regra de três para gramas:
CuO = 64 + 16 = 80 g/mol
CO2 = 12 + 2.16 = 44 g/mol
2 ⋅ 80 g CuO ------------------ 44 g CO2
8 g CuO ----------------------- x
Assim sendo:
2 ⋅ 80 ⋅ x = 8 ⋅ 44
x = 2,2 g de CO2
Questão 2
(FMP) O alumínio tem um largo emprego no mundo moderno, como em latas de refrigerante, utensílios de cozinha, embalagens, na construção civil, etc. Esse metal de grande importância possui caráter anfótero, que, colocado em ácido clorídrico ou em uma solução aquosa de hidróxido de sódio concentrado, é capaz de reagir, liberando grande quantidade de calor. Uma latinha de refrigerante vazia pesa, em média, 13,5 g. Uma experiência com cinco latinhas foi realizada em um laboratório para testar sua durabilidade como indicado na reação abaixo.
2 Al (s) + 6 HCl (aq) → 2 AlCl3 (aq) + 3 H2 (g)
O volume, em litros, de gás hidrogênio sob temperatura de 0 °C e pressão de 1 atm é de
A) 11,2
B) 16,8
C) 84
D) 28
E) 56
Resolução:
Alternativa C.
A reação já está balanceada, assim percebe-se que devemos utilizar a massa de 5 latinhas de alumínio (5 ⋅ 13,5 = 67,5 g) para dizer o volume de gás hidrogênio produzido nas CNTP (0 °C e 1 atm de pressão).
2 mols de Al ----------------- 3 mols H2
67,5 g Al --------------------- x
Ocorre que a única conversão conhecida para volume nas CNTP é: 1 mol de qualquer gás ocupa 22,4 L nas CNTP. Assim sendo, é mais fácil encontrar o valor de x em mols para depois ser convertido para litros.
Por isso, 67,5 gramas de Al devem ser convertidas para mols, de modo que toda a regra de três esteja em mols.
Al = 27 g/mol
1 mol Al ------------- 27 gramas
y ---------------------- 67,5 gramas
27 ⋅ y = 67,5; logo, y = 2,5 mols de Al.
Por isso, reescrevemos a regra de três principal como:
2 mols de Al ---------------- 3 mols de H2
2,5 mols de Al -------------- x
2,5 ⋅ 3 = 2 ⋅ x; logo, x = 3,75 mols de H2.
O volume de gás hidrogênio nas CNTP é dado por:
1 mol H2 ----------------- 22,4 L
3,75 mols H2 ------------ z
z = 3,75 ⋅ 22,4; logo, z = 84 L.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994. Disponível em: http://publications.iupac.org/pac/1994/pdf/6605x1077.pdf.
Por Stéfano Araújo Novais
Professor de Química







