Geralmente, ao estudar as reações, nós as encaramos como ideais, isto é, encaramos que todos os reagentes reagem completamente; exatamente como é descrito nas equações químicas. No entanto, no mundo real isto nem sempre ocorre. Uma série de fatores pode interferir no desenvolvimento de uma reação química.
Por exemplo: há a impureza dos reagentes, seu manejo inadequado, imprecisão das medidas efetuadas pelos aparelhos do laboratório ou máquinas industriais, não completude da reação no momento em as medições são feitas, uma reação concorrente (isto é, que ocorre exatamente ao mesmo tempo em que a nossa reação de interesse pode consumir os reagentes utilizados), a pressão e a temperatura podem variar, e assim por diante.
Todos esses fatores devem ser levados em consideração para que se prepare a máxima quantidade de produtos a partir de uma determinada quantidade de reagente. Vamos ver, por exemplo, o que acontece quando a reação não ocorre com o consumo total dos reagentes em razão do excesso de um deles, porque muitas vezes na indústria os reagentes não são colocados em contato nas proporções exatas.
Por exemplo, considere a reação abaixo entre o monóxido de carbono e o oxigênio:
2 CO (g) + O2 (g) → 2CO2(g)
Com base na proporção estequiométrica mostrada na reação balanceada acima, são necessárias duas moléculas de monóxido de carbono para reagir com uma de oxigênio, gerando duas moléculas de dióxido de carbono. A proporção é, portanto, 2 : 1 : 2. Se essa proporção for mudada e um dos reagentes estiver em excesso, a reação não ocorrerá da mesma maneira:
2 CO (g) + 2 O2 (g) → 2 CO2(g) + O2 (g)
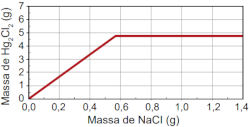
Considerando o exemplo acima, que não está na proporção estequiométrica, verifica-se que o monóxido de carbono é totalmente consumido enquanto que o oxigênio não. Isto significa que o oxigênio é o reagente em excesso e o monóxido de carbono é o reagente limitante.
O reagente limitante realmente limita a reação, pois depois que ele é totalmente consumido, a reação cessa, não importando a quantidade em excesso que ainda tenha do outro reagente.
Determinação do reagente limitante:
A partir da equação química balanceada é possível determinar quem é o reagente limitante e o que está em excesso e a relação entre as quantidades das substâncias envolvidas.
Vejamos um exemplo de como realizar este cálculo; consideremos o caso da combustão do álcool:
Problema: Uma massa de 138 g álcool etílico (C2H6O) foi posta para queimar com 320g de oxigênio (O2), em condições normais de temperatura e pressão. Qual é a massa de gás carbônico liberado e o excesso de reagente, se houver?
Resolução:
A reação balanceada é dada por:
1 C2H6O(V) + 3 O2(g) → 2CO2(g) + 3H2O(v)
1 mol 3 mol 2 mol
46 g 96g 88g
138g 320g
Só de analisarmos os dados, vemos que a massa de oxigênio é proporcionalmente maior que a do álcool, assim o oxigênio é o reagente em excesso e o álcool etílico é o reagente limitante.
Calculando a massa de gás carbônico formado a partir da quantidade do reagente limitante:
46g de C2H6O ------------88g de CO2
138g de C2H6O ------------x
x = 264 g de CO2
A massa de oxigênio em excesso é determinada de forma análoga:
46g de C2H6O ------------ 96 O2
138g de C2H6O ------------x
x = 288 g de O2
A massa em excesso é a diferença da massa que foi colocada para reagir e a que efetivamente reagiu:
320g - 288g= 32 g
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola